
| A、NaOH溶液 | B、KOH溶液 |
| C、盐酸 | D、氨水 |


科目:高中化学 来源: 题型:
| A、C(石墨,s)═C(金钢石,s)△H>0,说明石墨比金刚石稳定 | ||
B、NH3+H3O+?N
| ||
| C、2HCl+CaCO3═CaCl2+CO2↑+H2O,说明盐酸是强酸 | ||
| D、CH3COO-+H2O?CH3COOH+OH-,说明CH3COOH是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、具有很高的熔点,通常可用作耐高温的材料,熔融氢氧化钠可用此化合物制成的坩埚 |
| B、既能与强酸反应生成对应的盐和水也能与强碱反应生成对应的盐和水 |
| C、溶于水可生成对应的水化物 |
| D、与铁在高温下能发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往FeI2溶液中通人过量氯气:Cl2+2Fe2+=2Cl-+2Fe3+ |
| B、向Na[Al(OH)4]溶液中通入少量C02:2[Al(OH)4]-+CO2=2Al(OH)3↓+C032-+H2O |
| C、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3mol?L-1 |
| B、2mol?L-1 |
| C、1.5mol?L-1 |
| D、1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、4:1 |
| C、5:1 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | ||||
B、用浓盐酸与MnO2 反应制取少量氯气:MnO2+4H++2Cl-
| ||||
| C、向NaAlO2 溶液中通入过量的CO2 制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | ||||
| D、在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
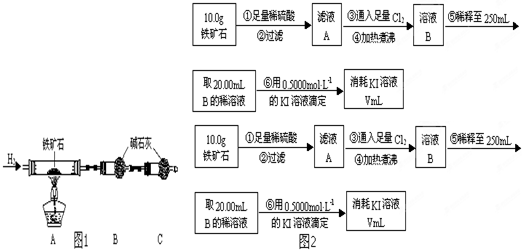
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com