
| A. | H2SO4、CH3CH2OH、CH3COONa和CaO分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 日常生活中无水乙醇常用于杀菌消毒 |
分析 A.乙醇不能电离产生氢氧根离子,不是碱;
B.电解质是指在水溶液中或熔融状态下能够导电的化合物,水溶液中能完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;非电解质是指在水溶液中和熔融状态下能够导电的化合物;
C.依据金属活泼性选择冶炼方法;
D.日常生活中常用75%的酒精杀菌消毒.
解答 解:A.H2SO4、CH3COONa和CaO分别属于酸、盐和氧化物,乙醇不是碱,故A错误;
B.电解质是指在水溶液中或熔融状态下能够导电的化合物,水溶液中能完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;非电解质是指在水溶液中和熔融状态下能够导电的化合物,蔗糖为非电解质,硫酸钡是强电解质,水为弱电解质,故B正确;
C.金属冶炼的原理是在金属活动顺序表中K~Al用电解法,Zn~Cu用还原法,Hg~Ag用加热法,铂、金物理分离法;所以Mg、Al、Cu可以分别用电解法、电解法、热还原法进行冶炼得到,故C错误;
D.杀菌消毒用的是医用酒精(75%),不是无水乙醇,故D错误;
故选:B.
点评 本题考查了酸、碱、盐和氧化物判断、电解质、非电解质判断、金属冶炼的方法,题目难度不大,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐的电离平衡被破坏 | B. | 水的电离程度一定会增大 | ||
| C. | 溶液的pH一定会增大 | D. | c(H+)与c(OH-)的乘积一定会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
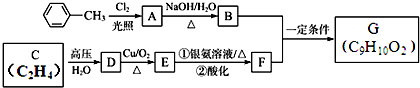
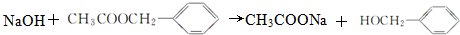 .
. 、
、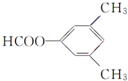 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2) | |
| B. | 用硅制作的太阳能电池是将化学能转化为电能 | |
| C. | 增加 Zn(g)的量,△H2变大 | |
| D. | Zn-Cu-CuSO4溶液构成的原电池中,Cu片质量增加,Zn片质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠存放于煤油中 | |
| B. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| C. | 铝片置于广口瓶中保存 | |
| D. | 将1mol/L的NaCl溶液保存在容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
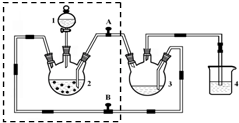 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| B. | Na的金属性比Cu强,故可用Na与CuSO4溶液反应制取Cu | |
| C. | 不能用带玻璃塞的玻璃瓶盛放碱液 | |
| D. | 玻璃、水泥、陶瓷、水晶都是重要的硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com