
| ||


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| A、VA=0.5mol/(L.min) |
| B、VB=0.3mol/(L.min) |
| C、Vc=2.4mol/(L.min) |
| D、VD=1mol/(L.min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
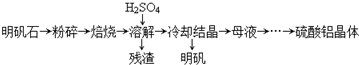
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
科目:高中化学 来源: 题型:

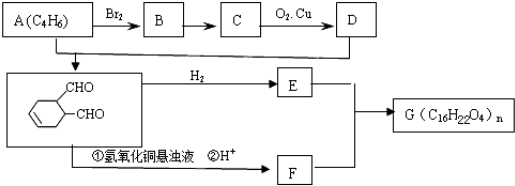
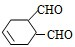 中含有的官能团的名称是
中含有的官能团的名称是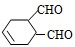 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度下,AgBr水溶液中c(Br-)和c(Ag+)的乘积是一个常数 |
| B、AgBr水溶液的导电能力很弱,所以AgBr为弱电解质 |
| C、室温下,AgBr在纯水中的溶解度大于在KBr溶液中的溶解度 |
| D、向饱和AgBr悬浊液中加入盐酸c(Br-)增大,Ksp值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有③ |
| C、①④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
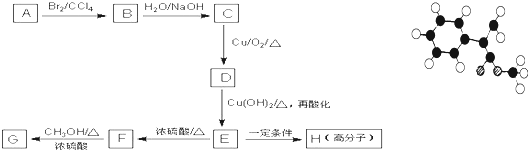
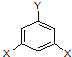 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、1mol | ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com