
【题目】Ⅰ.现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | _____ | ⑧⑨ | _____ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2,转移电子的数目为___________。
Ⅲ.Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________![]() _________+ ________+H2O
_________+ ________+H2O
【答案】 ③④: ⑦ ④ ③⑥⑩ KClO3 Cl2 5:1 0.4NA Mn2++BiO3-+H+![]() MnO4-+Bi3++H2O
MnO4-+Bi3++H2O
【解析】试题分析:(1)根据物质的元素组成,可以将物质分为纯净物和混合物,纯净物中,根据组成元素的种类可以将物质分为单质和化合物,只有一种元素组成的纯净物是单质,如氧气、铁,根据化合物的性质,可以将化合物分为酸、碱、盐、氧化物,如氧化钙、二氧化碳属于氧化物,根据混合物分散质微粒直径的大小,可以将混合物分为溶液(如硫酸钠溶液、稀硝酸)浊液和胶体(如红褐色的氢氧化铁液体)三种,化合物在水溶液或是熔融态下是否导电,可以将化合物分为电解质和非电解质,如CaO、H2SO4、Ba(OH)2、Cu2(OH)2CO3属于电解质,故答案为:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | ③④ | ⑧⑨ | ⑦ |
(2)在水溶液中和熔融状态下均不能导电的化合物是非电解质,非电解质包括蔗糖、酒精、非金属氧化物、NH3等,故为非电解质的是④; 电解质是在水溶液中或熔融状态下均不能导电的化合物,故是电解质的是③⑤⑥⑩,其中能和盐酸反应的是③⑥⑩,故答案为:④;③⑥⑩;
Ⅱ.(1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,KClO3为氧化剂,HCl为还原剂,当有3mol Cl2生成时,转移5mol电子,当有1mol Cl2生成时,氧化产物与还原产物的质量之比为5/3mol:1/3mol=5:1;
(2)标准状况下的Cl24.48L,n(Cl2)=4.48L÷22.4L/mol=0.2mol,
转移的电子为0.2mol×2×[0-(-1)]=0.4mol;
Ⅲ.发生BiO3---Bi3+的反应,Bi元素由+5价降低为+3价,则还发生Mn2+→MnO4-,Mn元素由+2升高为+7,发生Mn2++BiO3-+H+→MnO4-+Bi3++H2O,由电子守恒及质量守恒定律可知,该反应为2Mn2++5BiO3-+14H+═2MnO4-+5Bi3++7H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )

A. Z和W在该条件下至少有一个是为气态
B. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
C. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
D. 若在该温度下此反应平衡常数表达式为K= c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)标准状况下11.2L NH3中含_________个氨分子,_____________mol氢原子。
(2)等质量的SO2和SO3物质的量之比是_____________;所含的氧原子个数之比是________。
(3)含0.4mol A13+的Al2(SO4)3中所含的SO42﹣的物质的量是__________。
(4)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为![]() ,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有
,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有
①![]()
②![]()
③上述溶液中加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中加入等质量的水后,所得溶液的物质的量浓度大于0.5C
A. ②③ B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
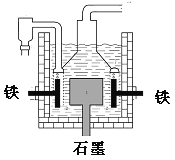
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)=4Na+O2↑+2H2O;后来盖· 吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:l
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2 L的密闭容器中进行反应:2A(g)![]() 3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为( )
3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为( )
A. v(B)=0.03 mol·L-1·s-1
B. v(B)=0.045 mol·L-1·s-1
C. v(C)=0.03 mol·L-1·s-1
D. v(C)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①________,②_________,③__________,④__________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净所用仪器
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在一定条件下,它们可以发生如图所示的转化关系,且E溶液是无色的.请据图回答:

(1)写出下列物质的化学式:A______,B______,C_____。
(2)写出下列反应的化学方程式:
反应①________________________
反应②________________________
反应③________________________
(3)实验室中保存少量单质A的方法是______;回答A的一种用途______________;A在空气中燃烧,所得产物中氧元素的化合价是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com