

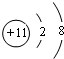 ,它的最高价氧化物对应水化物中含有的化学键有离子键、(极性)共价键,工业上冶炼D单质的化学方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑.
,它的最高价氧化物对应水化物中含有的化学键有离子键、(极性)共价键,工业上冶炼D单质的化学方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑. .
.分析 根据元素在周期表中的相对位置可知,A为H元素、B为N元素、C为O元素、D为Na元素、E为Mg元素、F为Cl元素,
(1)B为氮元素,根据其原子序数判断其在周期表中的位置;
(2)D为钠元素,钠离子的核电荷数为11,核外电子总数为10;钠的最高价氧化物对应的水化物为氢氧化钠,氢氧化钠中含有离子键和共价键;工业上通过电解熔融氯化钠获得金属钠;
(3)EF2为氯化镁,氯化镁为离子化合物,镁离子用离子符号表示,氯离子需要标出最外层电子及所带电荷;
(4)A2、C2分别为H2、O2,原电池中负极失去电子发生氧化反应,据此写出负极的电极反应式;根据电子守恒计算出消耗氧气的物质的量,再根据V=nVm计算出消耗氧气的体积.
解答 解:根据元素在周期表中的相对位置可知,A为H元素、B为N元素、C为O元素、D为Na元素、E为Mg元素、F为Cl元素,
(1)根据分析可知,B为N元素,其原子序数为7,位于周期表中第二周期、ⅤA族,
故答案为:N;第二周期第ⅤA族;
(2)D为Na元素,其简单离子为钠离子,钠离子的核电荷数为11,核外电子总数为10,钠离子结构示意图为: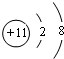 ;Na元素的最高价氧化物对应的水化物为NaOH,NaOH中既含有离子键,也含有共价键;工业上通过电解熔融氯化钠获得金属钠,反应方程式为:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,
;Na元素的最高价氧化物对应的水化物为NaOH,NaOH中既含有离子键,也含有共价键;工业上通过电解熔融氯化钠获得金属钠,反应方程式为:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,
故答案为: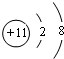 ;离子键、(极性)共价键;2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑;
;离子键、(极性)共价键;2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑;
(3)EF2为氯化镁,氯化镁为离子化合物,由离子形成离子键,其形成过程为: ,
,
故答案为: ;
;
(4)A2、C2分别为H2、O2,碱性燃料电池中,负极氢气失去电子与氢氧根离子反应生成水,电极反应式为:H2-2e-+2OH-=2H2O;
根据电子守恒,该电池工作过程中每通过2mol电子所需要的O2的物质的量为:$\frac{2mol}{4}$=0.5mol,标况下0.5mol氧气的体积为:22.4L/mol×0.5mol=11.2L,
故答案为:H2-2e-+2OH-=2H2O;11.2L.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度中等,涉及原子结构、电子式、原电池工作原理、物质的量的计算等知识,熟练掌握原子结构与元素周期表、元素周期律的关系为解答关键;(4)中负极电极反应式的书写为易错点,注意电解质为碱性,反应生成的是水.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的同分异构体共有(不考虑立体异构)5种 | |
| B. | 立方烷(C8H8)的六氯取代物有3种 | |
| C. | 分子式为C5H10O2的同分异构体中属于酯的有8种 | |
| D. | CH3 OCH3的一溴取代物有4种 OCH3的一溴取代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: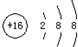 | B. | CO2的结构式:O=C=O | ||
| C. | 醋酸的分子式:CH3COOH | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油是多种碳氢化合物的混合物,可据各组分沸点不同进行分馏利用 | |
| B. | 煤的气化、液化是物理变化,煤的干馏是化学变化 | |
| C. | 天然气的主要成分是甲烷 | |
| D. | 酸雨形成的主要原因是含硫化石燃料的大量燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍原子失电子能力比镁弱 | B. | HI比HAt稳定 | ||
| C. | 氢氧化铝碱性比氢氧化镁强 | D. | 高氯酸的酸性比硫酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有③④ | C. | 只有①③ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | R |
| A. | 原子半径的大小顺序:Z>X>Y | |
| B. | W、Y的气态氢化物的稳定性:W>Y | |
| C. | Z单质一定是金属铝 | |
| D. | W、R的最高价氧化物对应水化物的酸性:W>R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com