
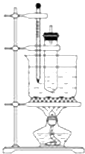
 苯与浓硝酸的反应:实验室制备硝基苯的实验装置如下图所示,主要步骤如下:
苯与浓硝酸的反应:实验室制备硝基苯的实验装置如下图所示,主要步骤如下: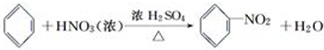 .
. 分析 (1)先加密度小的,后加密度大的,并不断搅拌,防止热量来不及散失导致液滴飞溅;
(2)水浴加热可保证温度在50~60℃下;
(3)洗涤和分离粗硝基苯,因硝基苯不溶于水,与混酸分层;
(4)H2SO 4、HNO3、NO2等与NaOH反应后,与硝基苯分层;
(5)硝基苯为密度比水大的无色液体;
(6)苯与浓硝酸发生取代反应生成硝基苯和水.
解答 解:(1)配制一定比例浓硫酸与浓硝酸形成的混合酸时,操作注意事项是先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却,
故答案为:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却;
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是反应器放在50~60℃的水浴加热,
故答案为:反应器放在50~60℃的水浴加热;
(3)因硝基苯不溶于水,与混酸分层,则步骤④中洗涤和分离粗硝基苯应使用的仪器是分液漏斗,
故答案为:分液漏斗;
(4)H2SO 4、HNO3、NO2等与NaOH反应后,与硝基苯分层,然后分液可分离,则步骤④中粗产品用5%NaOH溶液洗涤的目的是除H2SO 4、HNO3、NO2等物质,
故答案为:除H2SO 4、HNO3、NO2等物质;
(5)纯硝基苯是无色、密度比水大的油状液体,故答案为:大;
(6)苯与浓硝酸发生取代反应生成硝基苯和水,反应为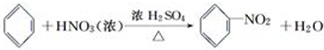 ,
,
故答案为: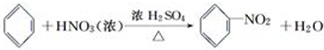 .
.
点评 本题考查有机物的制备实验,为高频考点,把握有机物的性质、制备原理、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,注意混合酸的加入顺序,题目难度不大.


科目:高中化学 来源: 题型:解答题



 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种. (任写一种)(任写一种).
(任写一种)(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
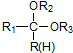 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$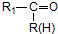
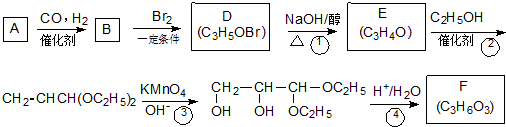
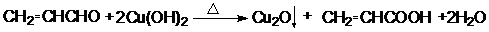 ;
;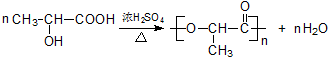 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的式量为720 | |
| B. | 它是一种单质 | |
| C. | 它是一种新型的共价化合物 | |
| D. | 它在氧气中燃烧的产物和碳在氧气中燃烧的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用精密pH试纸测得某碱溶液的pH为12.3 | |
| B. | 用25mL酸式滴定管量取13.50mLK2Cr2O7溶液 | |
| C. | 测定中和热实验的玻璃仪器只需烧杯、量筒和温度计 | |
| D. | 用带橡皮塞的试剂瓶保存Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.1mol/L的FeCl3溶液 | B. | 20mL 0.1mol/L的MgCl2溶液 | ||
| C. | 30mL 0.2mol/L的KCl溶液 | D. | 100mL 0.25mol/L的HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com