
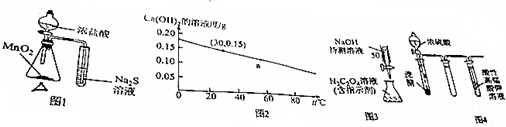
| A. | 图1的装置可用于比较MnO2、Cl2、S的氧化性 | |
| B. | 图2可知:30℃时Ca(OH)2溶液的浓度一定大于60℃时的温度 | |
| C. | 图3的装置可用于已知浓度的H2C2O4溶液测定未知浓度的NaOH溶液 | |
| D. | 图4的实验现象:酸性高锰酸钾溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
分析 A.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
B.根据图知,30℃时Ca(OH)2溶液的溶解度一定大于60℃时的温度,但30℃时Ca(OH)2溶液的浓度不一定大于60℃时的温度;
C.酸式滴定管只能盛放酸性溶液,碱性溶液应该用碱式滴定管盛放;
D.乙醇被高锰酸钾溶液氧化生成乙酸.
解答 解:A.该实验中,加热条件下,浓盐酸和二氧化锰反应生成氯气,氯气具有强氧化性,能氧化硫化钠生成硫单质,浓盐酸和二氧化锰的反应中二氧化锰是氧化剂、氯气是氧化物,所以氧化性:二氧化锰大于氯气;氯气和硫化钠的反应中,氯气是氧化剂、S是氧化产物,则氧化性氯气大于S,由此得出氧化性MnO2>Cl2>S,故A正确;
B.根据图知,30℃时Ca(OH)2溶液的溶解度一定大于60℃时的温度,但30℃时Ca(OH)2溶液的浓度不一定大于60℃时的温度,可能相等也可能小于,故B错误;
C.酸式滴定管只能盛放酸性溶液,碱性溶液应该用碱式滴定管盛放,NaOH溶液应该用碱式滴定管盛放,故C错误;
D.乙醇能被高锰酸钾溶液氧化生成乙酸而使酸性高锰酸钾溶液褪色,所以酸性高锰酸钾溶液褪色但没有气体生成,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化性强弱比较、溶解度与浓度关系、仪器的选取、乙醇的性质等知识点,侧重考查学生分析判断及基本操作能力,明确实验原理及基本操作方法是解本题关键,注意从实验操作规范性及评价性分析解答,易错选项是BD.


科目:高中化学 来源: 题型:选择题
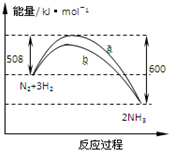
| A. | 1 mo N2与3 mo H2反应可以放出92 kJ的热量 | |
| B. | b曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该反应的焓变减小 | |
| D. | 正反应的活化能等于逆反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO2的质量为44g/mol | |
| B. | CO2的摩尔质量为44g | |
| C. | CO2的摩尔质量等于CO2的相对分子质量 | |
| D. | NA个CO2的质量与CO2的相对分子质量在数值上相同(NA为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B
,B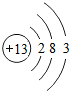 ,二者离子半径:Na+>Al3+(填离子符号).
,二者离子半径:Na+>Al3+(填离子符号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生的化学反应是复分解反应 | |
| B. | 反应的生成物中有Na2CO3 | |
| C. | 反应后形成的混合物的聚集颗粒直径为1~100nm | |
| D. | 反应说明硅酸易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com