
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 6:3:2 |
科目:高中化学 来源: 题型:选择题
| A. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28 mL | |
| C. | 常温常压下测得1 mol N2的质量为28 g | |
| D. | 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
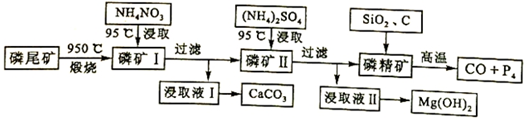
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
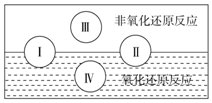 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应Ⅰ:△H>0,p2>p1 | B. | 反应Ⅳ:△H<0,T2>T1 | ||
| C. | 反应Ⅲ:可能是△H>0,T2>T1 | D. | 反应Ⅱ:△H<0,T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
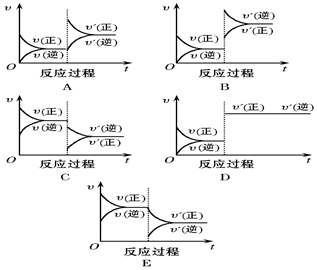 在一定条件下,反应A(g)+2B(s)?C(g)(正反应为吸热反应)达到平衡后,根据下列图象判断:
在一定条件下,反应A(g)+2B(s)?C(g)(正反应为吸热反应)达到平衡后,根据下列图象判断:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 晚上在家闻到一股浓重的煤气味,赶紧开灯检查一下 | |
| D. | 浓硫酸溅到皮肤上,立即用稀氢氧化钠溶液洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com