
| A. | 苯与浓硝酸、浓硫酸水浴加热并保持55~60℃反应生成硝基苯 | |
| B. | 乙醇在浓硫酸作催化剂和脱水剂且加热至170℃时发生消去反应生成乙烯 | |
| C. | 溴乙烷在氢氧化钠醇溶液中加热发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
分析 A.苯中H被硝基取代;
B.乙醇发生消去反应生成乙烯;
C.溴乙烷发生消去反应生成乙烯;
D.甲苯与氯气光照时甲基上H被取代.
解答 解:A.苯中H被硝基取代,则苯与浓硝酸、浓硫酸水浴加热并保持55~60℃反应生成硝基苯,故A正确;
B.乙醇发生消去反应生成乙烯,则乙醇在浓硫酸作催化剂和脱水剂且加热至170℃时发生消去反应生成乙烯,故B正确;
C.溴乙烷发生消去反应生成乙烯,则溴乙烷在氢氧化钠醇溶液中加热发生消去反应生成乙烯,故C正确;
D.甲苯与氯气光照时甲基上H被取代,苯环上H不能取代,则不能生成2,4二氯甲苯,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高考高频考点,把握官能团与性质、有机反应等为解答的关键,侧重分析与应用能力的考查,注意卤代烃与醇的消去反应条件不同,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物:Na2O、CaO、Al2O3、H2O | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 氧化物:Fe2O3、NO、SO2、CuO | D. | 酸:H2SO4、HNO3、NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学反应限度时,可生成2mol NH3 | |
| B. | 向容器中再加入N2,可以加快反应速率 | |
| C. | 降低温度可以加快反应速率 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶性:乙醇>新戊烷>苯酚 | |
| B. | 同质量的物质燃烧消耗O2量:乙烷>甲烷>乙炔 | |
| C. | 密度:水>苯>硝基苯 | |
| D. | 沸点:正戊烷>异戊烷>新戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
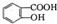 与适量NaHC03溶液反应制备
与适量NaHC03溶液反应制备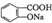
| A. | 只有①③④ | B. | 只有①③ | C. | 只有② | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
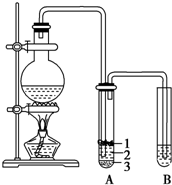 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
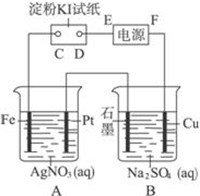 室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))
室温下,用下图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.若电解结束时,A、B装置中共收集到气体1.68L(标准状况),假设电解过程中无其他副反应发生,经测定电解后A中溶液体积恰为1000mL,求此时A溶液的pH值.(提示:pH=-lgc(H+))查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时,将胆矾晶体直接放在托盘天平的右盘上 | |
| B. | 准确称取16.0g胆矾,溶于水,待溶液恢复到室温,转移至1000mL容量瓶中,定容 | |
| C. | 准确称取25.0g胆矾,溶于水,待溶液恢复到室温,转移至1000mL容量瓶中,定容 | |
| D. | 定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com