
【题目】将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是( )
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4
科目:高中化学 来源: 题型:
【题目】某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3 . 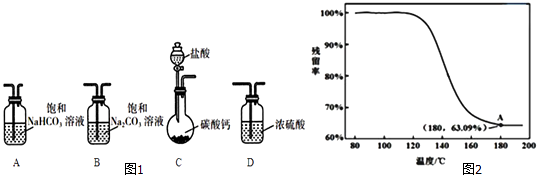
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 , 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 | 0.2molL﹣1 | 0.1molL﹣1 | 0.02molL﹣1 |
0.2molL﹣1 | 浑浊 | 浑浊 | 少许浑浊 |
0.1molL﹣1 | 浑浊 | 少许浑浊 | 无现象 |
0.02molL﹣1 | 少许浑浊 | 无现象 | 无现象 |
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l molL﹣1 NaHCO3溶液电离出的c(CO32﹣)为0.001lmolL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
答: .
(ii)产生浑浊(伴有气体产生)的离子方程式 .
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是 .
(残留率= ![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题: 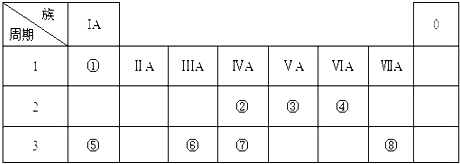
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)③的气态氢化物的电子式 .
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式、 .
(5)单质①在单质⑧中燃烧,火焰为色.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如图转化:下列相关离子方程式或化学方程式错误的是( ) ![]()
A.①可能为CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
B.①可能为Fe+2Fe3+═3Fe2+
C.②可能为2NO+O2═2NO2
D.②可能为CO ![]() +H2O+CO2═2HCO
+H2O+CO2═2HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用如图装置探究氨的催化氧化。
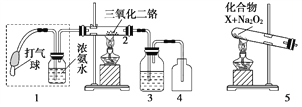
(1)氨催化氧化的化学方程式为____________________________________。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是________反应(填“吸热”或“放热”)。
(3)为保证在装置4中仅观察到红棕色气体,装置3应装入________;若取消3,在4中仅观察到大量白烟,原因是___________________________________。
(4)为实现氨催化氧化,也可用装置5替换装置________(填装置代号);化合物X为________(只写一种),Na2O2的作用是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是
A. 摩尔是国际科学界建议采用的一种物理量
B. 摩尔是物质的量的单位,简称摩,符号为mol
C. 1mol氧气含1mol氧原子
D. 1mol氢含6.02×1023个H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X,Y,Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X,Y,Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X,Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有二氧化硫等大气污染物,大气污染物的研究治理对改善环境具有重要意义。
I.为测定某工厂烟道气中SO2的含量,某兴趣小组同学做了如下实验:取标准状况下的烟气1.000L(内含氮气、氧气、二氧化硫、二氧化碳等),慢慢通过足量氯水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.233g。
(1)写出氯水与二氧化硫反应的离子方程式__________。
(2)加入过量的BaCl2溶液的日的是:____________,写出相关反应的离子方程式:__________。
(3)洗涤沉淀的方法是____________。
(4)计算该烟气样品中二氧化硫的体积分数___________。
II.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(5)在工业上采用氨法烟气脱硫技术,其做法是用雾化的氨水与烟气中的SO2直接接触吸收SO2,请写出氨水吸收SO2生成亚硫酸铵的化学方程式_________。
(6)该兴趣小组同学采用NaClO2溶液脱除SO2
①NaClO2中氯元素的化合价为_______。
②用1L0.1mol/L的NaClO2溶液最多可以吸收标准状况下的SO2_____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com