
| A、碘单质 | B、浓硝酸 |
| C、浓盐酸 | D、浓硫酸 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | ||||
B、用惰性电极电解饱和NaCl溶液:2H++2Cl-
| ||||
C、用石墨作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、钢铁发生吸氧腐蚀时负极反应为:Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸钠的热稳定性小于碳酸氢钠的热稳定性 |
| C、二者都能与足量盐酸反应放出二氧化碳气体,等物质的量时,产生气体的量和反应快慢都不同 |
| D、二者在一定的条件下可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
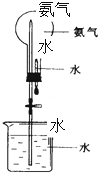 哈伯因为氨气的合成曾获1918年诺贝尔奖.
哈伯因为氨气的合成曾获1918年诺贝尔奖.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com