
| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 与石灰乳反应时,Cl2既被还原,同时又被氧化 | |
| D. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2与铁不能发生化学反应 |
分析 A.氯气密度大于空气密度;
B.氯气与水反应生成盐酸和次氯酸;
C.依据氯气与氢氧化钙反应中氯元素化合价变化解答;
D.铁与氯气在加热或点燃条件下反应生成氯化铁.
解答 解:A.氯气密度大于空气密度,可以用向上排空气法收集,故A正确;
B.氯气与水反应生成盐酸和次氯酸,次氯酸为弱酸,故B正确;
C.氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,氯元素化合价部分升高、部分降低,Cl2既被还原,同时又被氧化,故C正确;
D.铁与氯气在加热或点燃条件下反应生成氯化铁,故D错误;
故选:D.
点评 本题考查了氯气的性质,熟悉氯气的物理性质和化学性质是解题关键,注意标况下气体密度的计算方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(CO${\;}_{3}^{2-}$)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| C. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | c(Na+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,氯气的密度约为3.17g/L | |
| B. | 密闭容器中的氯水放置数天后,pH变小且几乎失去漂白性 | |
| C. | 液氯具有漂白性,干燥的氯气和液氯均能使干燥的有色布条褪色 | |
| D. | 在通常情况下,氯气可以和某些金属直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol锌粒与足量盐酸反应产生11.2LH2 | |
| B. | 标准状况下,11.2LCCl4所含分子数为0.5NA | |
| C. | 0.1mol CH4所含氢原子数为0.4NA | |
| D. | 常温常压下,28gN2中所含原子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个容积均为1L密闭容器中以不同的氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率α(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 氢碳比:X<2.0 | |
| C. | 在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) | |
| D. | P点温度下,反应的平衡常数为512 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
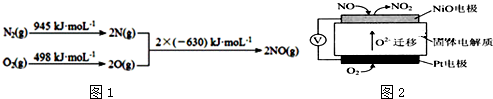
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com