
| A. | CO2和HCOOH均属于弱电解质 | B. | CO2和HCOOH均属于有机化合物 | ||
| C. | CO2转变为HCOOH发生还原反应 | D. | 1mol CO2的体积一定等于22.4L |
分析 A、弱电解质属于电解质,而电解质是在水溶液中或熔融状态下能导电的化合物;
B、含碳的化合物不一定为有机物;
C、根据CO2转变为HCOOH后碳元素的价态来分析;
D、二氧化碳所处的状态不明确.
解答 解:A、弱电解质属于电解质,而电解质是在水溶液中或熔融状态下能导电的化合物,由于CO在水溶液中和熔融状态下均不能导电,故不是电解质,更不是弱电解质,故A错误;
B、含碳的化合物不一定为有机物,如二氧化碳,由于在性质上非常像无机物,故二氧化碳属于无机物,故B错误;
C、CO2转变为HCOOH后碳元素的价态由+4价变为+2价,故发生了还原反应,故C正确;
D、二氧化碳所处的状态不明确,故1mol二氧化碳的体积不一定是22.4L,故D错误.
故选C.
点评 本题考查了电解质非电解质强弱电解质的判断、有机物的判断以及氧化反应和还原反应的辨析,难度不大,掌握基础是关键.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
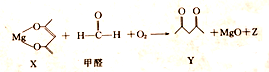
| A. | X 是还原剂 | B. | Y的分子式为C5H8O2 | ||
| C. | Z的摩尔质量为44g | D. | 除去1mol甲醛时,转移2mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
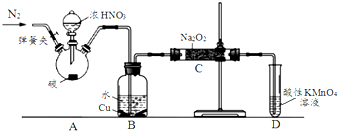
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com