
| A. | 与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | |
| B. | 加水稀释,氨水的电离平衡向逆反应方向移动 | |
| C. | 用HNO3溶液恰好完全中和,中和后溶液不显中性 | |
| D. | 其溶液的pH=13 |
分析 A.氨水为弱碱,离子方程式中一水合氨不能拆开;
B.稀释后,氨水的电离程度增大,平衡向着正向移动;
C.恰好反应时生成硝酸铵,铵根离子水解,溶液呈酸性;
D.氨水为弱碱,在溶液中不能部分电离出氢氧根离子,则该溶液中氢氧根离子浓度小于0.1mol/L.
解答 解:A.氨水与氯化铝反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.加水稀释,氨水的电离程度增大,则电离平衡向正反应方向移动,故B错误;
C.用HNO3溶液恰好完全中和,反应后溶质为硝酸铵,铵根离子部分水解,溶液呈酸性,故C正确;
D.氨水为弱碱,则0.10mol•L-1的氨水中氢氧根离子浓度小于0.1mol/L,该溶液的pH小于13,故D错误;
故选C.
点评 本题考查较为综合,涉及酸碱混合的定性判断、盐的水解原理、离子方程式书写、弱电解质电离平衡等知识,题目难度中等,明确电离平衡及其影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 碱性强弱:KOH>NaOH>LiOH | B. | 原子半径大小:Na>S>O | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙醇完全燃烧生成3mol水 | |
| B. | 乙醇能与水以任意比例互溶 | |
| C. | 乙醇沸点较高 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸存放在带玻璃塞的无色细口瓶中 | |
| B. | 少量碘储存在酒精中 | |
| C. | 氢氧化钠固体保存在磨口玻璃塞的试剂瓶中 | |
| D. | 少量金属钠保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
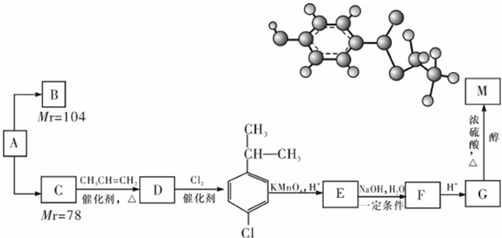
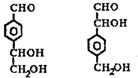
 .
.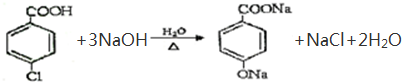 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “强水”可能是重水 | B. | “强水”可能是硝酸 | ||
| C. | “强水”可能具有强氧化性、强酸性 | D. | “强水”不可能是氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验式一定相同 | B. | 一定是同系物,有相同的通式 | ||
| C. | 只能是同种物质 | D. | 一定互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com