
| A. | CO2和SiO2都能与水反应生成相应的酸 | |
| B. | 硅可以用做半导体材料,SiO2可用于制光导纤维 | |
| C. | 氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中 | |
| D. | 玻璃是人类最早使用的硅酸盐材料,玻璃加热熔化时有固定的熔点 |
分析 A.二氧化硅不溶于水;
B.硅处于金属和非金属元素之间,其单质是良好的半导体材料;光导纤维的主要成分是二氧化硅;
C.玻璃中含有二氧化硅,二氧化硅是酸性氧化物,能和氢氟酸、强碱溶液反应;
D.人类最早使用的硅酸盐材料是陶瓷,晶体有固定熔点,非晶体没有熔点,玻璃是硅酸盐,没有固定的熔点;
解答 解:A.二氧化硅不溶于水,不能与水反应生成硅酸,故A错误;
B.硅处于金属和非金属元素之间,具有金属和非金属的性质,所以其单质是良好的半导体材料;光导纤维的主要成分是二氧化硅,是利用光的全反射原理,故B正确;
C.玻璃中含有二氧化硅,二氧化硅和氢氧化钠溶液生成粘性的硅酸钠不便于打开,所以不能用玻璃塞,故C错误;
D.人类最早使用的硅酸盐材料是陶瓷,玻璃是硅酸盐,因玻璃是玻璃态物质,是混合物,没有固定的熔点,故D错误;
故选B.
点评 本题考查硅及其化合物的性质和用途,明确物质的性质是解本题关键,题目难度不大..


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 012 | 011 | 010 | 010 |
| A. | 反应前2min的平均速率v(Z)=2.0×10-5 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正) | |
| C. | 该温度下此反应的平衡常数:K=1.44 | |
| D. | 保持其他条件不变,起始时向容器充入0.32 mol气体X和0.32mol气体Y,到达平衡时,n(Z)=0.024mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
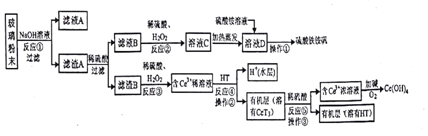
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 1L 0.1mol•L-1AlC13中所含Al3+离子数小于0.1NA | |
| C. | 1LpH=1的H2SO4溶液中含有的H+数为0.2NA | |
| D. | 常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2)=2.25 mol/L | B. | c(NH3)=1.9 mol/L | C. | c(H2)=0.3 mol/L | D. | c(N2)=1.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质为NaCl溶液,正极反应为H2+2e-=2H+ | |
| B. | 电解质为NaOH溶液,正极反应为O2+2e-=2OH- | |
| C. | 电解质为HCl溶液,正极反应为O2+4e-+4H+=2H2O | |
| D. | 电解质为Na2CO3溶液,正极反应为H2+2e-+CO32-=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中加入溴水后溴水层颜色变浅,这是由于发生了取代反应 | |
| B. | 乙烯和苯分子中所有原子在同一平面上 | |
| C. | 一氯丙烷(C3H7Cl)的同分异构体共有3种 | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为检验SO42-需要滴加稀硝酸酸化的BaCl2溶液并观察是否有白色沉淀生成 | |
| B. | 把光洁无锈的铁丝放在煤气灯外焰灼烧至与原来的火焰颜色相同时,蘸取K2CO3溶液并灼烧,透过蓝色钴玻璃可观察到火焰为淡紫色 | |
| C. | 向盛有足量苯酚溶液的试管中滴加少量稀溴水,可观察到白色沉淀生成 | |
| D. | 实验室制备乙炔时,常用NaOH溶液除去产生的H2S、PH3等杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com