
| A. | NO | B. | O2 | C. | NO2和O2 | D. | NO和O2 |
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个周期,8个主族 | |
| B. | 最外层电子数相同的元素一定在同一族 | |
| C. | 短周期元素中可能有副族元素 | |
| D. | 元素周期表有18个纵行,共16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
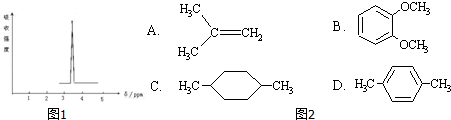
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫既可做氧化剂,又可做还原剂 | B. | SO3只有氧化性 | ||
| C. | 可以用铁罐贮运冷的浓H2SO4 | D. | H2S既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液;X、Y都是惰性电极,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液;X、Y都是惰性电极,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有溴元素,只需经过化学变化就可以得到高纯度的溴 | |
| B. | 海水淡化涉及到了化学变化 | |
| C. | 从海水中可以得到NaCl,除了食用外,还可以用于工业制氯气 | |
| D. | 海水中含有丰富的钠、镁、碘、金 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
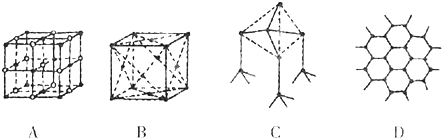
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com