
| A. | 被测样品中含有加热不挥发的杂质 | B. | 被测样品中含有加热易挥发的杂质 | ||
| C. | 实验前被测样品已有部分失水 | D. | 加热前所用的坩埚未完全干燥 |
分析 在测定中若被测样品中含有加热不挥发的杂质或实验前被测样品已有部分失水,都会造成测量结果偏低,据此进行解答.
解答 解:A.被测样品中含有加热不挥发的杂质会导致测定的水的质量偏小,故A正确;
B.被测样品中含有加热易挥发的杂质会导致测定结果偏大,故B错误;
C.实验前被测样品已有部分失水会导致测定的水的质量偏小,故C正确;
D.加热前所用的坩埚未完全干燥.加热后水挥发,导致水的质量测定结果偏大,故D错误;
故选AC.
点评 本题考查了硫酸铜晶体中结晶水含量测定方法及误差分析,题目难度不大,明确测定原理为解答关键,注意掌握硫酸铜晶体中结晶水含量测定的步骤,试题培养了学生的分析能力及化学实验能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHS水解反应:HS-+H2O═H3O++S2- | |
| B. | 1mol的Cl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 | |
| C. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向NaAlO2溶液中加入碳酸氢钠:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
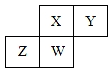 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | ZY2晶体熔化、液态Y3气化均需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
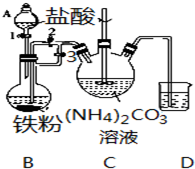 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
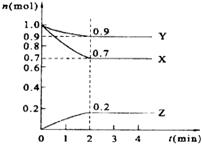 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
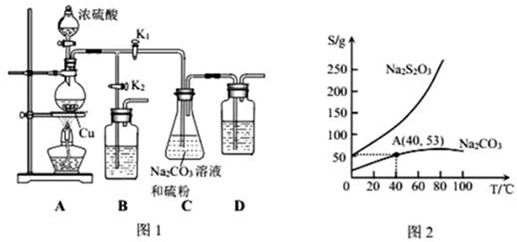
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com