
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)=c(CHCOO-)>c(H+)=c(OH-) | |
| D. | pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) |
分析 A.任何电解质溶液中都遵循电荷守恒,根据电荷守恒判断;
B.任何电解质溶液中都遵循电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
C.室温下,pH的溶液中c(H+)=c(OH-)且浓度很小,结合电荷守恒判断c(Na+)、c(CHCOO-)相对大小;
D.pH=4的NaHA溶液呈酸性,说明HA-的电离程度大于水解程度.
解答 解:A.任何电解质溶液中都遵循电荷守恒,根据电荷守恒得c(H+)+c(M+)=c(OH-)+c(A-),故A正确;
B.Na2CO3溶液转化存在电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒式为c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),则c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B正确;
C.室温下,pH的溶液中c(H+)=c(OH-)且浓度很小,结合电荷守恒得c(Na+)=c(CHCOO-),所以离子浓度大小顺序是c(Na+)=c(CHCOO-)>c(H+)=c(OH-),故C正确;
D.pH=4的NaHA溶液呈酸性,说明HA-的电离程度大于水解程度,所以c(H2A)<c(A2-),故D错误;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,再结合原子守恒、电荷守恒及质子守恒分析解答,易错选项是A.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 非金属元素只能形成共价化合物 | |
| B. | 在NaCl中,除Na+和Cl-的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 离子化合物可能含有共价键原子核之间的排斥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用可再生能源,用超临界二氧化碳替代有机溶剂,注重原子经济性,采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 13C与14C属于同一种元素,它们互为同位素 | |
| C. | 通过化学变化可以实现235U与238U的相互转化 | |
| D. | 同位素示踪法是研究化学反应历程的手段之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{WV{N}_{A}}{22.4M}$ | B. | $\frac{MV{N}_{A}}{22.4W}$ | C. | $\frac{WV}{22.4M}$ | D. | $\frac{MV}{22.4W}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠除去乙醇中混有的少量水 | |
| B. | 用湿润的蓝色石蕊试纸检验NH3 | |
| C. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| D. | 滴加数滴硫酸锌来加快铁与稀硫酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙能与冷水反应,镁与热水反应 | |
| B. | 碳酸镁微溶于水,碳酸钙难溶于水 | |
| C. | 氢氧化镁难溶于水,氢氧化钙微溶于水 | |
| D. | 钙能置换氯化镁溶液中的镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑧ | C. | ①④⑥ | D. | ④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
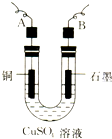 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器如下图所示,回答下列问题:
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器如下图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53和55 | B. | 131和137 | C. | 78和82 | D. | 76和79 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com