
| A、标况下,22.4L苯的分子数为NA |
| B、10.0mL 18mol/L的浓硫酸中氢离子数为0.36NA |
| C、6.4gS6与S8的混合物中所含S原子数一定为0.2NA |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |


科目:高中化学 来源: 题型:
| A、稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O | ||||
B、NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
| ||||
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
| D、KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、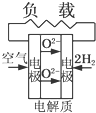 固体氧化物燃料电池 |
B、 碱性氢氧燃料电池 |
C、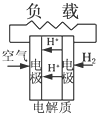 质子交换膜燃料电池 |
D、 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率变化时,化学平衡一定发生移动 |
| B、化学平衡发生移动时,化学反应速率一定变化 |
| C、正反应进行的程度大,正反应速率一定大 |
| D、改变压强,化学反应速率一定改变,平衡一定移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2CH4(g)+
| ||
B、2CH4(g)+
| ||
| C、3CH4(g)+5O2(g)=CO2(g)+2CO(g)+6H2O(g);△H=-1840kJ?mol-1 | ||
| D、3CH4(g)+5O2(g)=CO2(g)+2CO(g)+6H2O(1);△H=-1538kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 参考下列图表和有关要求回答问题:
参考下列图表和有关要求回答问题:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去Fe2(SO4)3溶液中混有的Fe SO4:加入足量新制氯水 |
| B、除去FeCl2溶液中混有的FeCl3:加入足量铁粉,过滤 |
| C、铝粉中的镁粉,加入足量氢氧化钠溶液,过滤 |
| D、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com