
【题目】已知苯与一卤代烷在催化剂作用下可生成苯的同系物:![]() +CH3X→
+CH3X→![]() +HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
+HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
A.CH2=CH2和HClB.CH3CH3和I2
C.CH2=CH2和Cl2D.CH3CH3和HCl
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】请回答下列问题:
Ⅰ.如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO2和CO反应的热化学方程式:______
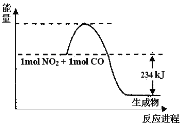
Ⅱ.现有①BaCl2②水晶③金属铝④Na2SO4⑤冰⑥碘片六种物质,按下列要求回答(填编号,下同):
(1)熔化时不需要破坏化学键的是_______,熔化时需要破坏共价键的是_______,能导电的是______。
(2)属于离子化合物的是________,只有离子键的物质是________,属于共价化合物的是______。
(3)①的电子式是________;⑤的结构式是________,⑤的空间构型是______,⑤中分子间作用力除了范德华力外,还含有______,因此而引起一些特殊的性质,请举出一种:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) ![]() CH3OH(g) 反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g) 反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
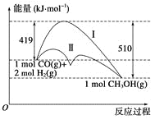
A.生成1mol CH3OH(g)时,该反应吸收的热量为91 kJ。
B.加入催化剂可以减少反应最终放出的热量
C.1mol CO(g)与2molH2(g)的总能量大于1mol CH3OH(g)的总能量
D.如果该反应生成CH3OH (l),则放出的能量会减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有________对自旋相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)____________I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是____________________________________;
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子_________________________的杂化方式。

(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含___________σ键数目。
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为________________;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标_______________________。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_________(填“高”或“低”),请解释原因___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.20 mol/LKMnO4酸性溶液 0.l0L与一定量pH=3.0的草酸(HOOC-COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.9 g HOOC-COOH含共用电子对数目为0.9NA
B.当0.01mol KMnO4 被还原时,强酸提供的H+数目为 0.01NA
C.pH=3.0的草酸溶液含有H+数目为0.001NA
D.该反应释放 CO2分子数目为VNA/22.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是( )

A.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流
B.装置Ⅱ中冷水的作用是冷凝收集裂化油
C.酸性KMnO4溶液若倒吸可加快褪色速率
D.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负性最小的元素。已知:A原子的核外电子数与电子层数相等;B元素原子的核外p电子数比s电子数少1个;C原子的第一至第四电离能为I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1,I4=10 540 kJ·mol-1;D原子核外所有p轨道为全充满或半充满;E元素的族序数与周期序数的差为4。
(1)写出E元素在周期表中位置:________;D元素的原子的核外电子排布式:__________________。
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为![]() 该同学所画的轨道式违背了________。
该同学所画的轨道式违背了________。
(3)已知BA5为离子化合物,写出其电子式:________。
(4)DE3中心原子杂化方式为________,其空间构型为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( )
A.-488.3kJ/molB.+488.3kJ/molC.+191kJ/molD.-191kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com