
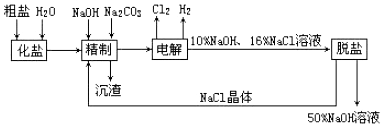
·ÖĪö ÓÉĮ÷³ĢæÉÖŖ£¬“ÖŃĪ¼ÓĖ®»ÆŃĪČܽāŗ󣬼ÓNaOH³żČ„Ć¾Ąė×Ó£¬¼ÓĢ¼ĖįÄĘ³żČ„øĘĄė×Ó£¬¾«ÖĘŗóµĆµ½µÄ³ĮŌüĪŖCaCO3”¢Mg£ØOH£©2£»¾«ÖĘŗóµÄŹ³ŃĪĖ®µē½āÉś³ÉNaOH”¢ĒāĘų”¢ĀČĘų£¬×īŗóĶŃŃĪ£ØNaClµČ£©µĆµ½øßÅØ¶ČµÄNaOHČÜŅŗ£¬
£Ø1£©µē½āĀČ»ÆÄĘČÜŅŗŹ±£¬Ńō¼«ÉĻĀČĄė×ӷŵēÉś³ÉĀČĘų£¬Ņõ¼«ÉĻĒāĄė×ӷŵēÉś³ÉĒāĘų£¬Ķ¬Ź±Ņõ¼«ø½½üÉś³ÉĒāŃõ»ÆÄĘ£»Ļ°¹ßÉĻ°Ńµē½ā±„ŗĶŹ³ŃĪĖ®µÄ¹¤ŅµÉś²ś½Š×öĀČ¼ī¹¤Ņµ£»
£Ø2£©¢ŁÓĆæÉČÜŠŌµÄĢ¼ĖįÄĘ³żČ„øĘĄė×Ó£¬ÓĆNaOH³żČ„Ć¾Ąė×Ó£»
¢ŚNa2O2Ķ¶ČėFeCl2ČÜŅŗ·¢Éś£¬¹żŃõ»ÆÄĘÓėĖ®·“Ӧɜ³ÉĒāŃõ»ÆÄĘŗĶŃõĘų£¬ĒāŃõ»ÆÄĘÓėĀČ»ÆŃĒĢś·¢Éśø“·Ö½ā·“Ӧɜ³ÉĒāŃõ»ÆĢś³Įµķ£¬ĒāŃõ»ÆŃĒĢś±»ŃõĘųŃõ»ÆÉś³ÉĒāŃõ»ÆĢś£¬¾Ż“Ė½įŗĻNa2O2ÓėFeCl2ČÜŅŗŅŌĪļÖŹµÄĮæ1£ŗ1·“Ó¦ŹéŠ“£»
£Ø3£©ÓŠŠ§³żČ„Ca2+”¢Mg2+”¢SO42-£¬Ó¦×¢ŅāĢ¼ĖįÄĘŌŚ±µŹŌ¼ĮÖ®ŗó¼Ó£»
£Ø4£©µē½ā±„ŗĶŹ³ŃĪĖ®Ńō¼«ŹĒĀČĄė×ÓŹ§µē×ÓÉś³ÉĀČĘų£¬Ņõ¼«ŹĒĒāĄė×ӵƵ½µē×ÓÉś³ÉĒāĘų£¬ŅĄ¾Żµē½āŌĄķ·ÖĪö£¬ŹéŠ“µē³Ų·“Ó¦£¬ŅĄ¾ŻÉś³ÉµÄĘųĢåĢå»ż£¬¼ĘĖćĒāŃõøłĄė×ÓÅØ¶Č£¬½įŗĻĄė×Ó»ż³£Źż¼ĘĖćĒāĄė×ÓÅØ¶Č¼ĘĖćČÜŅŗpH£»
£Ø5£©øł¾ŻĒāŃõ»ÆÄĘŗĶĀČ»ÆÄʵÄČܽā¶ČĖęĪĀ¶ČµÄ±ä»Æ¹ŲĻµĄ“Č·¶ØŹµĻÖĀČ»ÆÄĘŗĶĒāŃõ»ÆÄĘ·ÖĄė»ńµĆĀČ»ÆÄʵķ½·Ø½ųŠŠ·ÖĪö£»
£Ø6£©øł¾Ż·“Ó¦ĪļĀČ»ÆÄĘŗĶĖ®ĶصēÉś³ÉÉś³ÉĪļ“ĪĀČĖįÄĘŗĶĒāĘųŠ“³ö·“Ó¦·½³ĢŹ½£®
½ā“š ½ā£ŗ£Ø1£©µē½āŹ³ŃĪĖ®£¬ÓėÕż¼«ĻąĮ¬ĪŖŃō¼«£¬Éś³ÉĀČĘų£¬øƵē¼«·“Ó¦ĪŖ2Cl--2e-ØTCl2”ü£¬Ļ°¹ßÉĻ°Ńµē½ā±„ŗĶŹ³ŃĪĖ®µÄ¹¤ŅµÉś²ś½Š×öĀČ¼ī¹¤Ņµ£¬
¹Ź“š°øĪŖ£ŗ2Cl--2e-ØTCl2”ü£»ĀČ¼ī¹¤Ņµ£»
£Ø2£©¢ŁCa2+”¢Mg2+µČŌÓÖŹÓėĢ¼ĖįÄĘ”¢NaOH·“Ó¦×Ŗ»ÆĪŖ³Įµķ£¬Ąė×Ó·“Ó¦·Ö±šĪŖCa2++CO32-ØTCaCO3”ż”¢Mg2++2OH-ØTMg£ØOH£©2”ż£¬
¹Ź“š°øĪŖ£ŗCa2++CO32-ØTCaCO3”ż»ņMg2++2OH-ØTMg£ØOH£©2”ż£»
¢ŚNa2O2Ķ¶ČėFeCl2ČÜŅŗ·¢Éś£¬¹żŃõ»ÆÄĘÓėĖ®·“Ӧɜ³ÉĒāŃõ»ÆÄĘŗĶŃõĘų£¬ĒāŃõ»ÆÄĘÓėĀČ»ÆŃĒĢś·¢Éśø“·Ö½ā·“Ӧɜ³ÉĒāŃõ»ÆĢś³Įµķ£¬ĒāŃõ»ÆŃĒĢś±»ŃõĘųŃõ»ÆÉś³ÉĒāŃõ»ÆĢś£¬Éę¼°µÄ»Æѧ·½³ĢŹ½ŅĄ“ĪĪŖ£ŗ4Na2O2+4H2OØT8NaOH+2O2”ü”¢4FeCl2+8NaOHØT4Fe£ØOH£©2”ż+8NaCl”¢4Fe£ØOH£©2+O2+2H2OØT4Fe£ØOH£©3£¬ŌņNa2O2ÓėFeCl2ČÜŅŗŅŌĪļÖŹµÄĮæ1£ŗ1·“Ó¦£¬·“Ó¦µÄ×ÜĄė×Ó·½³ĢŹ½ĪŖ£ŗ4Na2O2+4Fe2++6H2O=4Fe£ØOH£©3”ż+8Na++O2”ü£¬
¹Ź“š°øĪŖ£ŗ4Na2O2+4Fe2++6H2O=4Fe£ØOH£©3”ż+8Na++O2”ü£»
£Ø3£©ÓŠŠ§³żČ„Ca2+”¢Mg2+”¢SO42-£¬Ó¦×¢ŅāĢ¼ĖįÄĘŌŚ±µŹŌ¼ĮÖ®ŗó£¬ŹĒĪŖ³żČ„¹żĮæµÄ±µĄė×Ó£¬ĻŌȻєĻībc·ūŗĻ£¬¹Ź“š°øĪŖ£ŗbc£»
£Ø4£©µē½ā±„ŗĶŹ³ŃĪĖ®Ńō¼«ŹĒĀČĄė×ÓŹ§µē×ÓÉś³ÉĀČĘų£¬Ņõ¼«ŹĒĒāĄė×ӵƵ½µē×ÓÉś³ÉĒāĘų£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ2Cl-+2H2O $\frac{\underline{\;Ķصē\;}}{\;}$H2”ü+Cl2”ü+2OH-£» µē½āŅ»¶ĪŹ±¼äŗóŹÕ¼Æµ½0.05molH2£¬ÉčČÜŅŗĢå»żŗćĪŖ1000mL£¬ŅĄ¾ŻĄė×Ó·½³ĢŹ½¼ĘĖćµĆµ½Éś³ÉĒāŃõøłĄė×ÓĪļÖŹµÄĮæĪŖ0.05”Į2=0.1mol£¬c£ØOH-£©=$\frac{0.1mol}{1L}$=0.1mol/L£»ĒāĄė×ÓÅضČĪŖ10-13mol/L£¬pH=13£¬¹Ź“š°øĪŖ£ŗ13£»
£Ø5£©ŅņĪŖĀČ»ÆÄʵÄČܽā¶ČĖę×ÅĪĀ¶Č±ä»Æ²»“ó£¬ĖłŅŌæÉŅŌ²ÉÓĆÕō·¢ÅØĖõČܼĮ½į¾§µÄ·½·Ø£¬Č»ŗó¹żĀĖÖĘµĆ¾§Ģ壬“Ó¶ų³żČ„ĒāŃõ»ÆÄĘÖŠµÄĀČ»ÆÄĘ£¬¹Ź“š°øĪŖ£ŗÕō·¢ÅØĖõ£»¹żĀĖ£»
£Ø6£©ČōĀČĘųŗĶĒāŃõ»ÆÄĘ³ä·Ö½Ó“„£¬²śĪļ½öŹĒ“ĪĀČĖįÄĘŗĶĒāĘų£¬Ōņ·¢ÉśµÄ·“Ó¦ĪŖ NaCl+H2O $\frac{\underline{\;µē½ā\;}}{\;}$NaClO+H2”ü£¬¹Ź“š°øĪŖ£ŗNaCl+H2O $\frac{\underline{\;µē½ā\;}}{\;}$NaClO+H2”ü£®
µćĘĄ ±¾Ģāæ¼²é“ÖŃĪĢį“æ¼°µē½āŌĄķ£¬Ć÷Č··¢ÉśµÄĄė×Ó·“Ó¦¼°µē½ā·“Ó¦ŹĒ½ā“šµÄ¹Ų¼ü£¬×¢Ņā³żŌÓ²»ÄÜŅżČėŠĀµÄŌÓÖŹ¼°ŹŌ¼ĮµÄĢķ¼ÓĖ³Šņ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢśÓėĻ”ĻõĖį·“Ó¦£ŗFe+2H+ØTFe2++H2”ü | |
| B£® | ĒāŃõ»ÆĢśČÜŅŗÓėŃĪĖį·“Ó¦£ŗOH-+H+ØTH2O | |
| C£® | ŠæÓėĮņĖįĶČÜŅŗ·“Ó¦£ŗZn+Cu2+ØTZn2++Cu | |
| D£® | ĒāŃõ»Æ±µČÜŅŗÓėĻ”ĮņĖį·“Ó¦£ŗH++SO42-+OH-+Ba2+ØTBaSO4”ż+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄNaA”¢HA»ģŗĻČÜŅŗ³Ź¼īŠŌ | |
| B£® | ĢįøßCO2ŁšĘųŃ¹Į¦£¬Ģ¼ĖįŅūĮĻÖŠc £ØA-£©¼õŠ” | |
| C£® | µ±Ģ¼ĖįŅūĮĻµÄpHĪŖ5.0Ź±£¬$\frac{c£ØHA£©}{c£Ø{A}^{-}£©}$=0.16 | |
| D£® | Ģ¼ĖįŅūĮĻÖŠø÷Į£×ÓµÄÅØ¶Č¹ŲĻµĪŖc£Ø H+£©=c£Ø HCO3-£©+2c£Ø CO32-£©+c£ØOH-£©-c£ØHA£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | KCl”¢Br2 | B£® | NaCl”¢KCl | C£® | KI”¢NaCl | D£® | NaCl”¢KCl”¢I2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢ß | B£® | ¢Ū¢Ü¢Ż¢Ž¢ß | C£® | ¢Ū¢Ż | D£® | ¢Ū¢Ü¢Ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 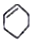 ŹōÓŚ·¼Ļć×å»ÆŗĻĪļ ŹōÓŚ·¼Ļć×å»ÆŗĻĪļ | B£® | 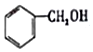 ŹōÓŚ·ÓĄą»ÆŗĻĪļ ŹōÓŚ·ÓĄą»ÆŗĻĪļ | ||
| C£® | 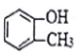 ŹōÓŚÖ¬»·»ÆŗĻĪļ ŹōÓŚÖ¬»·»ÆŗĻĪļ | D£® | CH3CH2CH£ØCH3£©2ŹōÓŚĮ“ד»ÆŗĻĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH3ŗĶHCl | B£® | CO2ŗĶSiO2 | C£® | ArŗĶAl | D£® | CCl4ŗĶNH4Cl |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com