

 .
.
分析 (1)依据1mol氢气完全燃烧生成液态水放出286KJ热量写出热化学方程式,标注物质聚集状态和对应焓变;
(2)根据不同聚集状态的水的能量不同,进行判断1molCH4气体完全燃烧生成CO2气体和水蒸气放出的热量;
(3)利用极限法计算;
(4)CO2气体和水的物质的量相等,利用讨论法计算;
(5)①共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;
②反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
③反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差;
④ⅰ在其他条件不变时,O2的量越大,HCl的转化率越大;
ⅱ依据化学平衡三段式列式计算得到;
(6)由实验测得该反应的△H=+50.5 kJ•mol-1,可知该反应是吸热反应,则反应物的总能量低于生成物的总能量,又依据活化能Ea=90.4 kJ•mol-1,Ea-△H<50.5kJ•mol-1;
由于该反应是一个分解反应,所以是一个混乱度增加(熵增)的反应,△S>0;而该反应又是一个吸热反应,△H>0,结合△G=△H-T△S判断.
解答 解:(1)1molH2在O2中完全燃烧,生成1mol液态水,放出286kJ热量,表示H2燃烧热的化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1;
(2)水由气态变为液态时要放出热量,由于1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热量,则1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量小于890kJ,
故答案为:<;
(3)amol全部是CO,放出热量为283a kJ;
同理,amol全部是CH4,放出热量为890a kJ;amol全部是H2,放出热量为286a kJ;
故将将amol CH4、CO和H2的混合气体完全燃烧生成气体和液态水,放出热量Q的取值范围是:283a kJ<Q<890akJ.
故答案为:283akJ<Q<890akJ;
(4)生成的CO2和液态H2O的物质的量相等,还用假设分析,有以下几种可能
①若无CO,生成的CO2和液态H2O的物质的量不相等,故不合题意
②若无H2,可能是CO和CH4各为$\frac{a}{2}$mol,
放出的热量(Q)=$\frac{a}{2}$×(283+890)=586.5a kJ,
③若无CH4,可能是CO和H2各为$\frac{a}{2}$mol,
放出的热量(Q)=$\frac{a}{2}$×(283+286)=284.5a kJ,
若无两种气体均不可能,
所以放出的热量(Q)的取值范围为:284.5a kJ<Q<586.5a kJ
故答案为:284.5a kJ<Q<586.5a kJ;
(5)①H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,故答案为:
,故答案为: ;
;
②依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
③E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,所以H2O中H-O 键比HCl中H-Cl键强;
故答案为:32;强;
④ⅰ在其他条件不变时,O2的量越大,HCl的转化率越大,由此可确定a为6:1,b为4:1,c为2:1,d为1:1,故答案为:4:1;
ⅱ由图可读出投料比为2:1、温度为400℃时,HCl的转化率为80%,设投入的HCl为2 mol,O2为1 mol,由此可建立三段式:
4HCl+O2 =2Cl2+2H2O
n(起始)/mol 2 1 0 0
n(转化)/mol 1.6 0.4 0.8 0.8
n(平恒)/mol 0.4 0.6 0.8 0.8
所以平衡混合气中Cl2的物质的量分数=$\frac{0.8mol}{0.4mol+0.6mol+0.8mol+0.8mol}$×100%=30.8%;
故答案为:30.8%;
(6)由实验测得该反应的△H=+50.5 kJ•mol-1,可知该反应是吸热反应,则反应物的总能量低于生成物的总能量.可排除能量关系图B和C,又依据活化能Ea=90.4 kJ•mol-1,Ea-△H<50.5kJ•mol-1,能量关系图A中Ea-△H>50.5 kJ•mol-1,Ea与△H的比例不对,而能量关系图D是合理的;由于该反应是一个分解反应,所以是一个混乱度增加(熵增)的反应,△S>0;而该反应又是一个吸热反应,即△H>0,由△G=△H-T△S可知,所以该反应在较高温度下有利于自发进行;
故答案为:D;>;较高.
点评 本题涉及热化学方程式、热化学方程式书写,化学键键能和焓变关系计算,图象分析判断、化学反应转化率计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C2H6、CH3CHO | D. | C3H8、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答:
原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答: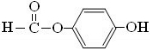 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据是否有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| D. | 根据组成元素的种类将纯净物分为单质和化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com