
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.分析 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,令F的最外层电子数为x,其质子数为10+x,则D原子最外层电子数为2x,质子数为2+2x,由于F的质子数比D多5,则有:10+x-(2-2x)=5,解得x=3,故F为Al、D为O,C、D、F三种元素的原子序数之和为28,则C的原子序数=28-8-13=7,故C为N;D与H分别为同主族,则H为S;B与G同主族,结合原子序数可知,处于ⅣA族,故B为C、G为Si,据此解答.
解答 解:A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,令F的最外层电子数为x,其质子数为10+x,则D原子最外层电子数为2x,质子数为2+2x,由于F的质子数比D多5,则有:10+x-(2-2x)=5,解得x=3,故F为Al、D为O,C、D、F三种元素的原子序数之和为28,则C的原子序数=28-8-13=7,故C为N;D与H分别为同主族,则H为S;B与G同主族,结合原子序数可知,处于ⅣA族,故B为C、G为Si,
(1)以上八种元素中的非金属中Si的非金属性最弱,其形成的最简单气态氢化物SiH4稳定性最弱,电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Na+>Al3+,故答案为:SiH4;Al3+;Na+;S2-;
(2)一定条件下,氢气与氮气充分反应可生成气体W为NH3,NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,由H、O两元素可以组成X、Y两种化合物,X在一定条件下可以分解生成Y,则X为H2O2、Y为H2O,H2O2分子中O原子之间形成1对共用电子对,H原子与O原子之间形成1对共用电子对,故其含有极性共价键和非极性共价键,双氧水具有还原性,高锰酸钾具有氧化性,两者能发生氧化还原反应,反应的离子反应方程式为:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O,固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的化学反应方程式为Na2O2+2H2O+Na2S=S↓+4NaOH,故答案为:
,由H、O两元素可以组成X、Y两种化合物,X在一定条件下可以分解生成Y,则X为H2O2、Y为H2O,H2O2分子中O原子之间形成1对共用电子对,H原子与O原子之间形成1对共用电子对,故其含有极性共价键和非极性共价键,双氧水具有还原性,高锰酸钾具有氧化性,两者能发生氧化还原反应,反应的离子反应方程式为:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O,固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的化学反应方程式为Na2O2+2H2O+Na2S=S↓+4NaOH,故答案为: ;极性键、非极性键;5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;Na2O2+2H2O+Na2S=S↓+4NaOH;
;极性键、非极性键;5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;Na2O2+2H2O+Na2S=S↓+4NaOH;
(3)二氧化硅与碳在高温下反应生成CO与Si,化学反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,二氧化硅中Si由+4价变为0价,1mol二氧化硅反应转移电子数为4mol,1.2g二氧化硅的物质的量为:$\frac{1.2g}{60g/mol}$=0.02mol,0.48g C单质的物质的量为$\frac{0.48g}{12g/mol}$=0.04mol,故两者恰好完全反应,转移电子数为0.02mol×4=0.08mol,
故答案为:0.08NA;
(4)氢气与氧气可以构成燃料电池,氢气在负极失去电子,结合氢氧根生成水,电极反应方程式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O.
点评 本题结构性质位置关系综合应用,涉及元素周期律、比较离子半径、电子式、氧化还原反应、离子反应方程式等,难度中等,推断元素是解题的关键.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
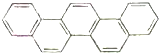 第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )
第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )| A. | 该有机物的一氯代物共有四种 | |
| B. | 该有机物是只含非极性键的非极性分子 | |
| C. | 该有机物属于芳香族化合物,是苯的同系物 | |
| D. | 该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
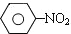 $\stackrel{Fe、HCl、H_{2}O}{→}$
$\stackrel{Fe、HCl、H_{2}O}{→}$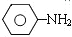 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化) $\stackrel{KMnO_{4}、H+}{→}$
$\stackrel{KMnO_{4}、H+}{→}$
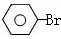 $→_{高温、加压}^{NaOH溶液、催化剂}$
$→_{高温、加压}^{NaOH溶液、催化剂}$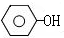
 (对氨基水杨酸钠)
(对氨基水杨酸钠) +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$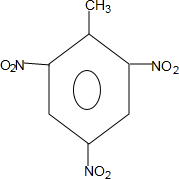 +3H2O
+3H2O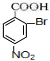 D:
D: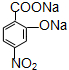 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子 | |
| B. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| D. | 碱金属和卤素单质的熔沸点均随原子序数的增大而逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 2:6:3 | C. | 3:6:2 | D. | 2:1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com