

分析 矿渣样品(主要成分为Al2O3,还含有少量Fe2O3)加入浓氢氧化钠溶液加热反应,氧化铝和氢氧化钠溶液反应生成偏铝酸钠,过滤得到固体A为Fe2O3,滤液为偏铝酸钠溶液C,经步骤Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成氢氧化铝和碳酸氢钠,氢氧化铝加热分解生成氧化铝,
(1)固体和液体分离用过滤装置;
(2)步骤Ⅰ中发生的化学反应是氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水;
(3)固体A中阳离子为铁离子检验时需要盐酸溶解成溶液,加入KSCN溶液显红色证明,氧化铁和酸反应生成盐和水,和碱不反应属于碱性氧化物;
(4)氢氧化铝是两性氢氧化物溶于强酸强碱,不溶于弱酸弱碱,可以在氯化铝溶液中加入过量的氨水反应生成氢氧化铝沉淀;
解答 解:矿渣样品(主要成分为Al2O3,还含有少量Fe2O3)加入浓氢氧化钠溶液加热反应,氧化铝和氢氧化钠溶液反应生成偏铝酸钠,过滤得到固体A为Fe2O3,滤液为偏铝酸钠溶液C,经步骤Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成氢氧化铝和碳酸氢钠,氢氧化铝加热分解生成氧化铝,
(1)固体和液体分离用过滤装置,步骤Ⅰ中分离A和C的实验操作名称是过滤,
故答案为:过滤;
(2)步骤Ⅰ中发生的化学反应是氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水;,反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(3)固体A中阳离子为铁离子检验时需要盐酸溶解成溶液,加入KSCN溶液显红色证明,加入的试剂为盐酸、KSCN溶液,固体B为氧化铝和酸反应生成盐和水,和碱反应生成盐和水,属于两性氧化物,故选ac,
故答案为:盐酸、KSCN溶液;ac;
(4)氢氧化铝是两性氢氧化物溶于强酸强碱,不溶于弱酸弱碱,可以在氯化铝溶液中加入过量的氨水反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
点评 本题考查了物质分离和提纯的过程,主要是氧化铝、氧化铁性质,注意氢氧化铝是两性氢氧化物,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | m1>m2 | B. | m1<m2 | C. | m1≥m2 | D. | m1≤m2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 要鉴别的物质组 | 试剂 | 方法 |
| A | NaCl/Na2CO3 | BaCl2溶液 | 观察是否产生沉淀 |
| B | NO2/Br2 | 湿润的淀粉碘化钾试纸 | 观察试纸是否变蓝色 |
| C | 乙醇/乙酸 | 新制氢氧化铜悬浊液 | 观察溶液是否变澄清 |
| D | CO2/SO2 | 品红溶液 | 观察溶液红色是否退去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
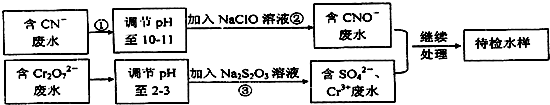
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
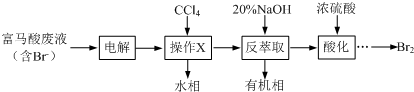
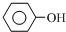 +3Br2→
+3Br2→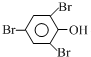 ↓+3HBr
↓+3HBr查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与H2O2 | B. | ${\;}_{6}^{12}C$与${\;}_{6}^{14}C$ | ||
| C. | 石墨与金刚石 | D. | 正丁烷与异丁烷 | ||
| E. | . |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com