
用黄铁矿可以制取硫酸,再用硫酸制取化肥硫酸铵.今燃烧含PeS2为80%的黄铁矿75t,生产出79.2t硫酸铵.若在制取硫酸铵时硫酸的利用率为90%;则用黄铁矿制取硫酸时的损失率为________.
科目:高中化学 来源:物理教研室 题型:022
查看答案和解析>>
科目:高中化学 来源: 题型:022
用黄铁矿可以制取硫酸,再用硫酸制取化肥硫酸铵。今煅烧FeS2的质量分数为80%的黄铁矿75t,生产出79.2t硫酸铵。若在制取硫酸铵时,硫酸的利用率为90%,则用黄铁矿制取硫酸时的损失率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:058
用黄铁矿可以制取硫酸,再用硫酸制取化肥硫酸铵,今燃烧含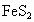 为80%的黄铁矿75t,生产出79.2t硫酸铵,若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的硫的损失率为多少?
为80%的黄铁矿75t,生产出79.2t硫酸铵,若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的硫的损失率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com