
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
科目:高中化学 来源: 题型:选择题
 常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | a、b点所示溶液中水的电离程度不相同 | |
| C. | b恰好完全中和,pH=7说明NH4R没有水解 | |
| D. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
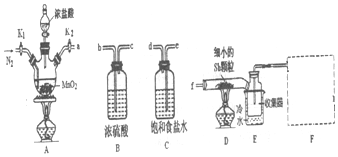
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 电离能 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6O2属于酯时有三种同分异构体 | |
| B. | 乙醇、乙酸均能与钠反应放出H2,二者分子中官能团相同 | |
| C. | 向 溶液中通入CO2可得到 溶液中通入CO2可得到 | |
| D. | CH3COOH与CH3CH218OH发生酯化反应可生成CH3CO18OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r 为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色。上述的转化关系如图所示。下列说法中不正确的是( )

A. 原子半径:Y< X< Z B. 非金属性:Y> X> W
C. m与q、n与s均不能共存 D. 若n过量,q还可以继续燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com