
| A. | 相对平均分子质量增大 | B. | V正增大,V逆减小 | ||
| C. | A的转化提高 | D. | 反应放出的总热量大于原来的2倍 |
分析 体积不变,再向容器中充入amolA,物质的量增大,相当于压强增大,则3A(g)?B(g)正向移动,以此来解答.
解答 解:体积不变,再向容器中充入amolA,物质的量增大,相当于压强增大,则3A(g)?B(g)正向移动,
A.由M=$\frac{m}{n}$可知,质量为原来的2倍,再达到平衡时混合气体的物质的量小于原来的2倍,则相对平均分子质量增大,故A正确;
B.相当于压强增大,则V正、V逆都增大,故B错误;
C.反应物只有A,且3molA生成1molB,转化程度大,平衡正向移动时A的转化提高,故C正确;
D.再次达到平衡后,与原平衡比较,反应的A的物质的量大于原来的2倍,则反应放出的总热量大于原来的2倍,故D正确;
故选B.
点评 本题考查化学平衡的移动,为高频考点,把握反应的特点、物质的量增大转化为压强增大分析平衡移动为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| B. | Na2O2中阳离子与阴离子的个数比为1:1 | |
| C. | Ba(OH)2•8H2O晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 | |
| D. | 由H2→2H的过程需要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓氨水可以检验MgCl2、Al2(SO4)3、NaNO3溶液 | |
| B. | 用NaClO溶液检验FeSO4溶液是否变质 | |
| C. | 用盐酸和KSCN溶液检验Fe(NO3)2溶液中是否含有Fe3+ | |
| D. | 用盐酸可以检验黑色粉末氧化铜、二氧化锰、铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
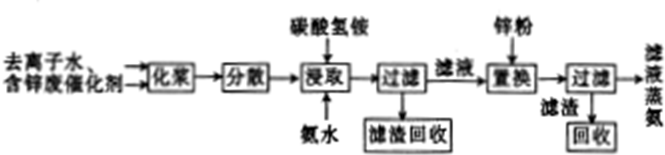
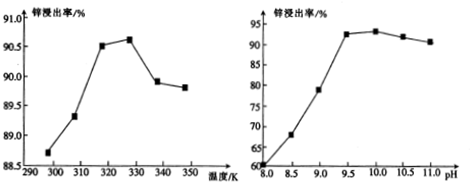
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有Cl-存在 | |
| B. | 加入几滴KSCN溶液,溶液变成红色,可确定有Fe3+存在 | |
| C. | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 | |
| D. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
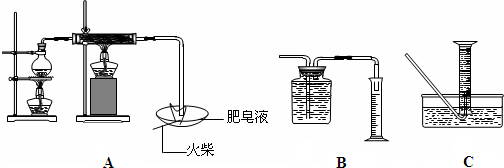
| 现象 | 结论与解释 | |
| 可能① | ||
| 可能② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com