已知下列热化学方程式:
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.5kJ/mol
(2)2C2H6(g)+7O2(g )═4CO2(g)+6H2O(l)△H=-3116.7kJ/mol
(3)C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-1409.6kJ/mol
(4)2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2596.7kJ/mol
(5)C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2217.8kJ/mol
现有由上述五种烃中的两种组合成的混合气体2mol,经充分燃烧后放出3037.6kJ热量,则下列哪些组合是不可能的( )
A.CH4和C2H2
B.C2H4和C3H8
C.C2H6和C3H8
D.C2H6和CH4
【答案】分析:这道题用平均值特点,结合极限假设法来解答.要产生要求中需要的热量,又限制气体体积,就是要两中气体中,其中一种的燃烧值高于3037.6kJ,一种低于3037.6kJ
A、2molCH4(g)或2molC2H2(g)产生的热量都少于3037.6kJ
B、2molC3H8的燃烧放热4435.6KJ高于3037.6kJ,2molC2H4放热2819.2KJ,低于3037.6kJ;
C、2molC2H6燃烧放热3116.7KJ;2molC3H8燃烧放热4435.6KJ;
D、2molC2H6燃烧放热3116.7KJ;2molCH4燃烧放热1779KJ.
解答:解:A、2 mol CH4完全燃烧放出 889.5×2=1779kJ 而 2 mol C2H2完全燃烧放出 2596.7kJ,如果全部是C2H2,都只能产生 2596.7kJ热量(最大极限),不可能产生3037.6kJ热量,故A符合;
B、2 mol C2H4完全燃烧放出1409.6×2=2819.2kJ 而 2 mol C3H8完全燃烧放出 2217.8×2=4435.6kJ,很明显 2819.2kJ<3037.6kJ<4435.6kJ,所以B有可能,故B不符合;
C、2 mol C2H6完全燃烧放出 3116.7kJ,而2 mol C3H8完全燃烧放出 4435.6kJ,如果全部是C2H6(最小极限),都最少能产生 3116.7kJ热量都大于3037.6kJ,所以C也不可能,故C符合;
D、2 mol C2H6完全燃烧放出 3116.7kJ,而2 mol CH4完全燃烧放出 889.5×2=1779kJ,而 1779kJ<3037.6kJ<3116.7kJ 所以D也是有可能的,故D不符合;
故选AC.
点评:本题考查了物质燃烧放热的定量计算比较,主要是混合气体燃烧放热的分析判断,极值判断是解题关键,题目难度中等.



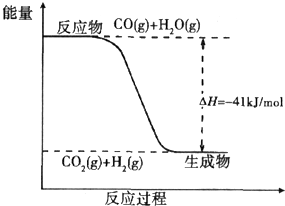 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.