
下列各组中的性质比较,不正确的是( )
A.稳定性:NH3<PH3<SiH4
B.酸性:HClO4>H2SO4>H3PO4
C.碱性:KOH>NaOH>Mg(OH)2
D.还原性:F-<Cl-<Br-
科目:高中化学 来源: 题型:
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( )
| 氧化物 | 环境问题 | 主要来源 | |
| A | CO | 煤气中毒 | 含碳燃料的不完全燃烧 |
| B | SO2 | 光化学烟雾 | 汽车尾气的排放 |
| C | NO2 | 温室效应 | 工厂废气的排放 |
| D | CO2 | 酸雨 | 化石燃料的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z中,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X2+的氧化性小于Y3+的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次增大
B.W与Z一定具有相同的最高正化合价
C.W的最高价氧化物的水化物一定是强酸
D.以X、Y、硫酸铜溶液组成的原电池中,Y作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.X+、Y3+
C.Y3+、Z2- D.X+、Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是
;W的单质与氢氟酸反应生 成两种无色气体,该反应的化学方程式是 。
成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101Kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419KJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。下列说法正确的是( )

A.Y、W的最简单氢化物的水溶 液都呈酸性
液都呈酸性
B.X、Y与Z中的任意两种元素均可形成两种或两种以上的化合物
C.上述四种元素形成的化合物都抑制水的电离
D.W的单质可从Z的最简单氢化物中置换出Z的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。

请回答下列问题:
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是____________________________;
(2)图中ΔH=________kJ·mol-1;
(3)V2O5的催化循环机 理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:_____________________________________________;
理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:_____________________________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。(已知燃烧热是指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=== NH 4Cl(s)在室温下可自发进行,则该反应的△H<0
4Cl(s)在室温下可自发进行,则该反应的△H<0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中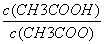 的值减小
的值减小
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验.

已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10﹣5,其饱和溶液中c(OH﹣)约为1×10﹣3mol•L﹣1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: .
(2)上述流程中两次使用试剂①,推测试剂①应该是 A (填以下字母编号)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)固体E为 ,写出溶液F通入过量CO2生成固体G和溶液H的化学方程式: .
(5)计算溶液F中c(Mg2+)= (25℃时,氢氧化镁的Ksp=5.6×10﹣12)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com