
| A. | CaCO3与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | Ba(OH)2与H2SO4反应:H++OH-=H2O | |
| C. | 铁与醋酸反应:Fe+2H+=Fe2++H2↑ | |
| D. | NaHCO3与NaOH反应:HCO3-+OH-=CO32-+H2O |
分析 A,碳酸钙在离子反应中保留化学式;
B.漏写生成硫酸钡的离子反应;
C.醋酸在离子反应中保留化学式;
D.反应生成碳酸钠和水.
解答 解:A.CaCO3与盐酸反应的离子反应为CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.Ba(OH)2与H2SO4反应的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.铁与醋酸反应的离子反应为Fe+2CH3COOH=2CH3COO-+Fe2++H2↑,故C错误;
D.NaHCO3与NaOH反应的离子反应为HCO3-+OH-=CO32-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
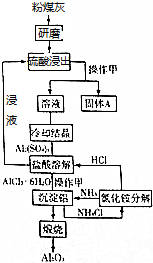 我国煤炭丰富、电离偏紧的资源特征决定了在今后相当长一段时间内,火力发电仍将在电力工业中占据重要地位.粉煤灰是火电厂排出的主要固体废物.其中粉煤灰中主要含有SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如图所示:
我国煤炭丰富、电离偏紧的资源特征决定了在今后相当长一段时间内,火力发电仍将在电力工业中占据重要地位.粉煤灰是火电厂排出的主要固体废物.其中粉煤灰中主要含有SiO2、Al2O3、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | CaCO3=CaO+CO2↑ | D. | Mg+2HCl=MgCl2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟利昂(CCl2F2)会破坏大气臭氧层从而导致“温室效应” | |
| B. | 开发高效氢能、太阳能灯新能源汽车,可以减缓城市机动车尾气污染 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 铁与硝酸反应后溶液中一定有Fe3+存在 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,可制成玻璃容器盛装氢氟酸 | |
| B. | 氧化铁为红棕色固体,可用于作油漆红色涂料 | |
| C. | 次氯酸有酸性,可用于自来水的杀菌消毒 | |
| D. | 钠具有金属活泼性,钠可以从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
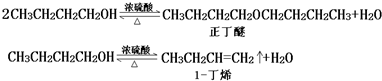
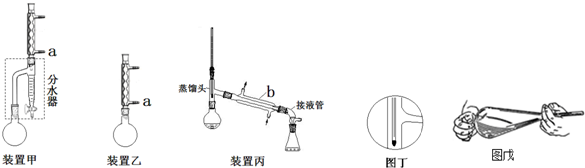
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com