
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9 mol,这些气体恰好能被500 mL 2 mol·L-1 NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液。下列说法不正确的是
A.消耗硝酸的物质的量为2.5mol
B.气体中N2O4的物质的量为0.1mol
C.生成NaNO3的物质的量为0.2 mol
D.生成的氮的氧化物的混合气倒置于水槽中,通入标准状况下8.96L O2时,气体完全被吸收
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 加入稀盐酸,将产生的气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸是中强酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,下列关系正确的是
①c(K+)+c(H+)=c(HC2O )+c(OH-)+c(C2O
)+c(OH-)+c(C2O )
)
②c(HC2O )+c(C2O
)+c(C2O )=0.1 mol·L-1
)=0.1 mol·L-1
③c(C2O )>c(H2C2O4)
)>c(H2C2O4)
④c(K+)=c(H2C2O4)+c(HC2O )+c(C2O
)+c(C2O )
)
A.①② B.①④ C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验或操作正确的是

A.实验I:制氨气 B.实验II:蒸发、浓缩、结晶
C.实验III:配制1∶1的稀硫酸 D.实验IV:用 标准溶液滴定未知浓度的Na2SO3溶液
标准溶液滴定未知浓度的Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.在原电池中,负极材料的活性一定比正极材料强
B.将氯化铁溶液蒸干可得无水氯化铁固体
C.反应2NO2(g)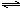 N2O4(g)在常温下就能自发进行,则该反应的ΔH>0
N2O4(g)在常温下就能自发进行,则该反应的ΔH>0
D.氯化铵溶液中加入镁,会产生两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.pH=1的溶液中:Fe2+、NO 、SO
、SO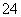 、Na+
、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的溶液中:NH 、Al3+、NO
、Al3+、NO 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO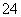 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中,正确的是 ( )
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO )>c(SO
)>c(SO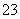 )>c(OH-)
)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式
(i) I2(g)+H2(g) 2HI(g) △H= - 9.48kJ/mol
2HI(g) △H= - 9.48kJ/mol
(ii) I2(s)+H2(g) 2HI(g) △H=+ 26.48kJ/mol
2HI(g) △H=+ 26.48kJ/mol
下列判断正确的是
A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,a g气体A与b g气体B的分子数相同,下列说法中,不正确的是( )
A.A和B的相对分子质量之比为a∶b
B.同温同压下,A与B的密度之比为b∶a
C.同质量的A与B的物质的量之比为b∶a
D.同温同压下,同体积的A与B的质量之比为a∶b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com