
【题目】六偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由白磷(P4:易自燃,熔点44℃,沸点280℃,有剧毒,保存在冷水中)制备六偏磷酸钠的方法如下:
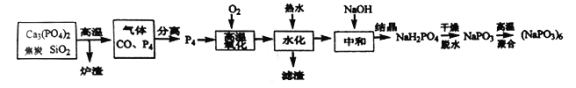
(1)“炉渣”的主要成分是___________(写化学式),该过程中氧化剂与还原剂的物质的量之比是_______________。
(2)从混合气体中分离得到P4的最佳方法是_________________。
(3)经分析“滤渣”是由白磷中的Pb、As杂质元素所形成的两种盐类,其中一种是Pb3(PO4)2,则另一种是_______________ (写化学式)。
(4)若直接将白磷与足量浓NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体。写出该化学方程式____________________。
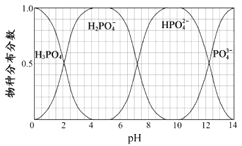
(5)已知磷酸中含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示,则“中和”过程中应加入NaOH调节溶液的pH值为________________。若pH过低,则造成的结果是_________________。
(6)经定量分析,毎100.00g产品的有效磷(以P2O5计)含量是66.50g (其它杂质为非磷酸盐成分),则该产品的纯度是__________________。(已知:NaPO3的相对分子质量为M1,P2O5的相对分子质量为M2,结果不必化简,列出计算式即可)
【答案】 CaSiO3 1:5 将混合气体通入冷水中,过滤 Pb3(AsO4)2 P4+3NaOH(浓)+ 3H2O![]() 3NaH2PO2+PH3↑ 5 (或5左右) pH过低,NaOH加入过少,H3PO4不能完全转化为NaH2PO4,磷元素利用低
3NaH2PO2+PH3↑ 5 (或5左右) pH过低,NaOH加入过少,H3PO4不能完全转化为NaH2PO4,磷元素利用低 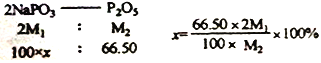
【解析】本题考查化学工艺流程,(1)根据流程图,Ca3(PO4)2、焦炭、SiO2反应生成CO和P4,根据元素守恒,因此炉渣的成分是CaSiO3;氧化剂Ca3(PO4)2,还原剂是焦炭,根据得失电子数目守恒,n[Ca3(PO4)2]×2×5=n(C)×2,即n[Ca3(PO4)2]:n(C)=1:5;(2)P4保存在冷水中,CO不溶于水,因此将混合气体通入冷水中,过滤;(3)因为生成两种盐,盐是由酸和碱发生中和反应生成,因此另一种盐为Pb3(AsO4)2;(4)P4转化成NaH2PO2,P的化合价升高,根据氧化还原反应的规律,还有P的化合价降低,产生有毒气体,即为PH3,反应式为P4+NaOH→NaH2PO2+PH3↑,利用化合价升降法,进行配平,即P4+3NaOH(浓)+ 3H2O![]() 3NaH2PO2+PH3↑;(5)根据流程,加入NaOH得到NaH2PO4,因此控制pH在5左右;根据图像,pH过低,主要以H3PO4的形式存在,不能全部转化成H2PO4-,磷元素利用较低;(6)令产品为100g,纯度为x,根据磷元素守恒,产品的纯度x=
3NaH2PO2+PH3↑;(5)根据流程,加入NaOH得到NaH2PO4,因此控制pH在5左右;根据图像,pH过低,主要以H3PO4的形式存在,不能全部转化成H2PO4-,磷元素利用较低;(6)令产品为100g,纯度为x,根据磷元素守恒,产品的纯度x=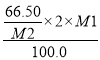 。
。


科目:高中化学 来源: 题型:
【题目】高倩同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关【科学探究】为基础,设计了如下实验装置并记录相关实验数据。
【实验装置】

【部分实验数据】
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)下列叙述不正确的是________。
A.气体摩尔体积与气体的温度相关
B.在该实验条件下,3 mol O2的气体摩尔体积为74.58 L·mol-1
C.同温、同压下,2 mol CO、CO2混合气体和2 mol O2的体积相同
D.该实验条件下,O2的密度为1.287 g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SO2能使溴水、KMnO4水溶液褪色
B.可以用澄清石灰水鉴别SO2与CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.少量SO2通入浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)______molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(4)标准状况下,密度为0.75g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(5)已知agA和bgB恰好完全反应生成0.2molC和dgD,则C的摩尔质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和相同体积相同pH值的Ba(OH)2,NaOH和NH3H2O三种稀溶液所用相同浓度盐酸的体积分别是V1,V2,V3,它们的关系是 ( )
A. V3>V2>V1 B. V3>V2=V1 C. V3=V2>V1 D. V1=V2>V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 已知25 ℃时NH4CN溶液显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B. 室温时, 相同体积、相同pH的盐酸和醋酸溶液中由水电离出的c(H+):盐酸小于醋酸溶液
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时, CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图完成回收硫酸亚铁和铜的简单实验方案,回答下列问题:(流程图中无需填写)

(1)试剂①为____,操作⑥名称为_______和洗涤,其中洗涤的操作方法是_______________。为检验沉淀是否洗涤干净,可向最后一次洗涤液中加入试剂:__________。
(2)试剂⑤的化学式为_____,所发生的化学方程式为___________________________。
(3)对④和⑧的混合溶液,不选用蒸发结晶(余热蒸干)获得FeSO4·7H2O,原因是_____、________。(说出两点原因)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com