
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应式为2CH2===CH2+O2===2CH3CHO。下列有关说法正确的是
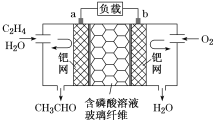
A. 每有0.1 mol O2反应,则迁移H+0.4 mol
B. 负极反应式为CH2===CH2-2e-+H2O===CH3CHO+2H+
C. 电子移动方向:电极a→磷酸溶液→电极b
D. 该电池为二次电池
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol N2(g) +2O2(g) = 2NO2(g)△H = +133kJ/mol、H2O(g) = H2O(l) △H = -44kJ/mol。催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为_____________________。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
(1)①该反应自发进行的条件是__________(填“低温”、“高温”或“任意温度”),
②下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均式量保持不变 ;b.CO2和H2的体积分数保持不变;
c. CO2和H2的转化率相等 ;d.混合气体的密度保持不变
e.1molCO2生成的同时有3molH—H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6内CO2的浓度随时间的变化_____。

(2)改变温度,使反应CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:

①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)_______K(II)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________。在其它条件不变下,若30min时只改变温度为T2 ℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”)。若30min时向容器中再充入1molCO2和1molH2O(g),则平衡_________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0 g 14%的NaCl溶液与30.0 g 24%的NaCl溶液混合,混合后得到密度为 1.17 g·cm-3的溶液。请计算:
(1)混合后的溶液中NaCl的质量分数是多少?___________
(2)混合后的溶液的物质的量浓度为多少?_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A分子式为CxHyOz,15g A完全燃烧生成22g CO2和9gH2O。
(1)该有机物的最简式是___________________。
(2)若A是一种无色具存强烈剌激性气味的气体,具有还原性,则其结构简式是_________。
(3)A中只有一种官能团,若A和Na2CO3混合有气体放出,和醇能发生酯化反应,则A的结构简式为___________________。
(4)A中只有一种宫能团,若A是易挥发有水果香味的液体,能发生水解反应,则其结构简式为___________________。
(5)若A其分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
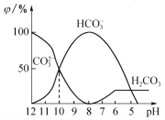
A. Na2CO3溶液中c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3)
B. pH=8时,溶液中c(Cl-)=c(Na+)
C. pH =7时,溶液中的c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的Kh=10-10mol·L-1
HCO3-+OH-的Kh=10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用FeS处理含Cu2+和Pb2+废水后的废弃固体(主要成分CuS、FeS、PbS、SiO2)制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:

(1)提高步骤①反应速率的措施,除温度外,还有_____________(写一条);
(2)处理废水时,FeS与Pb2+反应的离子方程式为____________;
(3)固体A的主要成分是_______________(填化学式);
(4)步骤⑤中,所加试剂x为____________(填标号);
a.Cl2 b.H2O2 c.KMnO4 d.HNO3
(5)检验溶液B完全转化为溶液C的试剂是_________________________;
(6)潮湿多雨的夏季,在细菌作用下,废石堆中的硫化铜与硫酸铁转化为含重金属盐的酸性废水(硫元素全部进入溶液中)而污染土壤。该转化反应的离子方程式为____________;
(7)已知,常温下FeS、CuS的Ksp分别为6.5x10-18和1.3x10-36)。现用过量的FeS处理含0.01mol·L-1 Cu2+的废水,处理后废水中c(Cu2+)=______mol·L-1(忽略体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有甲基、苯基、羟基、羧基四种基团,在它们两两组合形成的化合物中,写出具有以下性质的物质的结构简式:
(1)能使石蕊试液变色的有______种.
(2)催化氧化后产物能与新制氢氧化铜发生氧化还原反应的是______
(3)不同情况下与氢氧化钠反应能生成两种盐的是______.
II、有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)A的相对分子质量为:________. |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为:________. |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况). | (3)用结构简式表示A中含有的官能团:________、________. |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子. |
(5)综上所述,A的结构简式________. | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL 0.1 molL-1Na2CO3溶液中逐滴加入0.1 molL-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2 因逸出未画出,忽略因气体遭出而引起的溶液体积变化),下列说法正确的是
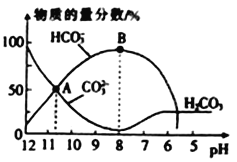
A. A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+ c(OH-)
B. 在B点所示的溶液中,浓度最大的离子是HCO3-
C. 当熔液的pH 为7时,溶液中的阴离子只有两种
D. 已知25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按系统命名法填写下列有机物的名称及有关内容:
(1)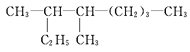 的名称是________________
的名称是________________
(2)2,6-二甲基-4-乙基辛烷的结构简式是________________________,1 mol该烃完全燃烧需要消耗氧气________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com