
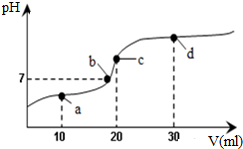
 常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )
常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),在这个过程中,溶液的pH变化如图所示(横坐标为Ba(OH)2的体积),下列溶液中关于粒子浓度的叙述不正确的是( )| A. | a点:c(CH3COO-)>c(Ba2+)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | a至d点过程中:c(Ba2+)一定大于c(OH-) | |
| C. | c点:c(CH3COOH)+c(H+)=c(OH-) | |
| D. | d点:c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) |
分析 常温下,向20mL 0.1mol•L-1醋酸溶液中不断滴加0.05mol•L-1 Ba(OH)2(aq),2CH3COOH+Ba(OH)2=(CH3COO)2Ba+2H2O,未滴入前含有乙酸n(CH3COOH)=2×10-3mol,
a点:滴加0.05mol•L-1 Ba(OH)2(aq)10mL,此时溶液中滴入n[Ba(OH)2]=5×10-4mol,消耗CH3COOH的量为1×10-3mol,生成n[(CH3COO)2Ba]=5×10-4mol,剩余CH3COOH的量为2.5×10-4mol,
b点时:醋酸钡是强碱弱酸盐其水溶液呈碱性,当酸碱恰好反应时溶液应该呈碱性,但b点溶液呈中性,说明酸过量,
C点:滴加0.05mol•L-1 Ba(OH)2(aq)20mL,此时溶液中滴入n[Ba(OH)2]=1×10-3mol,消耗CH3COOH的量为2×10-3mol,生成n[(CH3COO)2Ba]=1×10-3mol,无CH3COOH剩余,
d点:滴加0.05mol•L-1 Ba(OH)2(aq)30mL,此时溶液中滴入n[Ba(OH)2]=1.5×10-3mol,消耗CH3COOH的量为2×10-3mol,生成n[(CH3COO)2Ba]=1×10-3mol,无CH3COOH剩余,剩余n[Ba(OH)2]=5×10-4mol,结合电荷守恒和物料守恒分析判断.
解答 解:A.a点:2CH3COOH+Ba(OH)2=(CH3COO)2Ba+2H2O,溶液中电荷守恒:2c(Ba2+)+c(H+)=c(OH-)+c(CH3COO-),乙酸过量,溶液呈酸性,c(H+)>c(OH-),所以c(CH3COO-)>2c(Ba2+),生成n[(CH3COO)2Ba]=5×10-4mol,剩余CH3COOH的量为2.5×10-4mol,CH3COOH?CH3COO-+H+,c(Ba2+)>c(CH3COOH),乙酸弱电解质部分电离,c(CH3COOH)>c(H+),故A正确;
B.Ba(OH)2=Ba2++2OH-,a至b点过程中,溶液由酸性变为中性,c(Ba2+)一定大于c(OH-),C点:n[(CH3COO)2Ba]=1×10-3mol,CH3COO-+H2O?CH3COOH+OH-,水解程度很小,所以c(Ba2+)一定大于c(OH-),d点:滴入n[Ba(OH)2]=1.5×10-3mol,n(Ba2+)=1.5×10-3mol,剩余n[Ba(OH)2]=5×10-4mol,溶液中n(OH-)=1×10-3mol,c(Ba2+)>c(OH-),所以a至d点过程中:c(Ba2+)一定大于c(OH-),故B正确;
C.C点:滴加0.05mol•L-1 Ba(OH)2(aq)20mL,此时溶液中滴入n[Ba(OH)2]=1×10-3mol,消耗CH3COOH的量为2×10-3mol,恰好生成n[(CH3COO)2Ba]=1×10-3mol,溶液中电荷守恒:2c(Ba2+)+c(H+)=c(OH-)+c(CH3COO-)①,物料守恒可知2c(Ba2+)=c(CH3COO-)+c(CH3COOH)②,②代入①得:c(CH3COOH)+c(H+)=c(OH-),故C正确;
D.d点:滴加0.05mol•L-1 Ba(OH)2(aq)30mL,此时溶液中滴入n[Ba(OH)2]=1.5×10-3mol,消耗CH3COOH的量为2×10-3mol,生成n[(CH3COO)2Ba]=1×10-3mol,剩余n[Ba(OH)2]=5×10-4mol,溶液中n(Ba2+)=1.5×10-3mol,忽略水解n(CH3COO-)=1×10-3mol,剩余n[Ba(OH)2]=5×10-4mol,溶液中n(OH-)=1×10-3mol,乙酸根离子水解,所以c(Ba2+)>c(OH-)>c(CH3COO-)>c(H+),故D错误;
故选D.
点评 本题考查酸碱混合的判断和离子浓度大小比较,答题时注意a、b、c、d点溶液的组成,把握弱电解质的电离和盐类水解的特点,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
 磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质.已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾.
磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质.已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热法炼铁:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | |
| B. | 工业上用NH3制备NO:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| C. | 向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+═H2O+CO2↑ | |
| D. | 过氧化钠用于呼吸面具中作为氧气的来源:2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫是一种淡黄色的难溶于水的晶体,既有氧化性又有还原性 | |
| B. | NO2溶于水生成硝酸,所以NO2是酸性氧化物 | |
| C. | Cl2能在常温下与金属活动性顺序表中大多数金属反应 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质不活泼,在自然界中有游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业中使用催化剂 | |
| B. | 用铁粉代替铁钉与稀硫酸反应制取氢气 | |
| C. | 食品放在冰箱中贮藏 | |
| D. | 进行铝和盐酸反应时,稍微加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com