
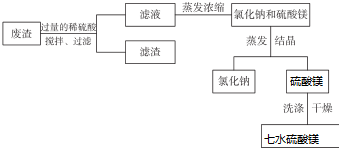
分析 某工厂的废渣中含NaCl、Mg ( OH)2、CaCO3、BaCO3等,加入过量的稀硫酸溶解NaCl、Mg(OH)2、CaCO3溶于硫酸生成硫酸钙和硫酸镁,过滤后得滤渣为BaSO4、SiO2,对滤液进行蒸发浓缩,使部分氯化钠析出,过滤后将滤液冷却结晶使硫酸镁晶体析出,再经过滤、洗涤、干燥可得MgSO4•7H2O,
(1)实验过程中搅拌可使二氧碳析出,促使碳酸钙转化为硫酸钙;
(2)除去滤液中含有H+,要不引入新的杂质,据此选择;
(3)根据溶液中溶解度小的物质先析出判断,因为硫酸镁晶体中含有结晶水,所以要从溶液中获得硫酸镁晶体可以用降温结晶的方法;
(4)所得 MgSO4•7H2O 如果不纯,可能含有的杂质为氯化钠,所以可以通过检验钠离子的方法判断MgSO4•7H2O 是否纯净.
解答 解:(1)在废渣中加入过量的稀硫酸,发生反应CaCO3+H2SO4=CaSO4+H2CO3,搅拌可使 Mg(OH)2、BaCO3转化为硫酸盐,且搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4=CaSO4+H2CO3右移,
故答案为:使 Mg(OH)2、BaCO3转化为硫酸盐,且搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4=CaSO4+H2CO3右移;
(2)除去滤液中含有H+,要不引入新的杂质,所以可以加入MgO、MgCO3或Mg(OH)2,
故答案为:MgO、MgCO3或Mg(OH)2;
(3)根据溶液中溶解度小的物质先析出,所以此温度下硫酸镁的溶解度比氯化钠大,因为硫酸镁晶体中含有结晶水,所以要从溶液中获得硫酸镁晶体可以用冷却结晶的方法,
故答案为:大;冷却结晶;
(4)所得 MgSO4•7H2O 如果不纯,可能含有的杂质为氯化钠,所以可以通过检验钠离子的方法判断MgSO4•7H2O 是否纯净,其操作为用洗净的铂丝蘸取洗净槽中的最后清液,在酒精灯上灼烧,如果显黄色,则所得MgSO4•7H2O不纯净,如果不显黄色,则所得MgSO4•7H2O纯净,
故答案为:用洗净的铂丝蘸取洗净槽中的最后清液,在酒精灯上灼烧,如果显黄色,则所得MgSO4•7H2O不纯净,如果不显黄色,则所得MgSO4•7H2O纯净.
点评 本题考查物质的制备实验,是一道物质的分离和提纯的方法和基本操作的综合应用题,充分考查学生的分析、理解能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++SO42-+Ba2++4OH-═NH3•H2O+Al(OH)3↓+BaSO4↓ | |
| D. | 酸性溶液中KIO3与KI反应:I-+IO3-+6H+═I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
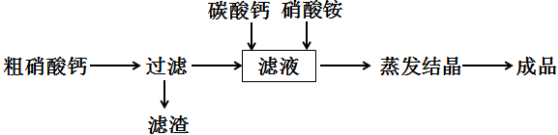

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
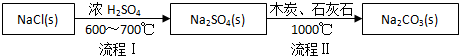
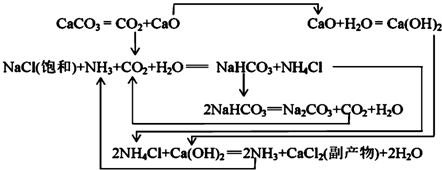
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
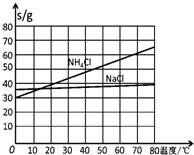
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
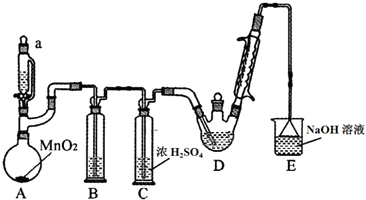
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水,乙醇 | 可溶于水,乙醇,三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
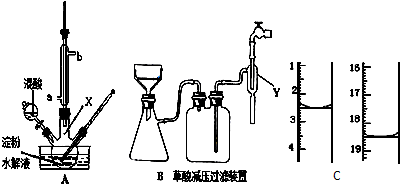
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
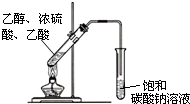 以乙烯为原料,可以制备乙酸乙酯
以乙烯为原料,可以制备乙酸乙酯查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.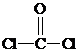 ,其中碳氧原子之间共价键是c(填序号)
,其中碳氧原子之间共价键是c(填序号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com