
【题目】下列关于化学平衡的判断正确的是( )
A.化学平衡向正反应方向移动,反应物的转化率不一定增大
B.对于放热反应,降低温度将缩短反应达到平衡的时间
C.对于有气体参加的反应,改变反应体系的压强,化学平衡一定移动
D.同一可逆反应,在温度![]() 时,反应对应的平衡常数
时,反应对应的平衡常数![]() ,则说明该反应为放热反应
,则说明该反应为放热反应
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)![]() 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度
A. ①②④ B. ②③ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是质子数依次增大的短周期主族元素,它们形成的某种化合物Q的结构式如图所示。X与W形成的化合物M常温下是液体。下列说法正确的是
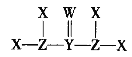
A.X与Z可形成质子数、电子数均相同的ZX3、![]()
B.M热稳定性强且具有弱氧化性
C.Q分子中各原子最外电子层均达到稳定结构
D.X、Y、Z、W四种元素间只能形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.利用键长及键能的数据可判断:稳定性![]()
B.金属的电子气理论,可以解释金属易导电易腐蚀的原因
C.化学反应过程中一定有化学键的变化,这是反应过程中能量变化的本质原因
D.活化能越大就代表化学反应需要吸收或放出的能量就越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下22% 硝酸钠溶液150 mL,加入100 g水稀释后溶质质量分数变为14%。
(1)原硝酸钠溶液的质量是__________。
(2)原硝酸钠溶液的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.18 g冰水混合物中有NA个原子和10NA个电子
B.常温常压下16 g 氧气和臭氧混合气体含有NA个氧原子
C.标准状况下,33.6 L水含有1.5NA个水分子
D.2.24 L二氧化碳中含有0.3NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A,B分别为0.6mol和0.5mol,在0.4L密闭容器中发生反应:3A+B![]() aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
A.此时,反应混合物总物质的量为1molB.B的转化率40%
C.A的平均反应速率为0.1mol/(L·min)D.a值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
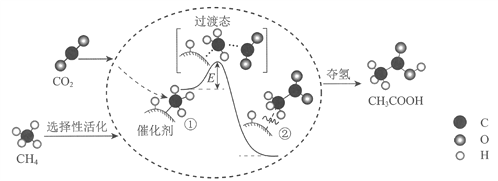
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若1.92 g Cu粉与一定量浓HNO3反应,当Cu完全反应时,收集到标准状况下1.12L气体,则消耗硝酸________mol,生成NO2________mol;
(2)若向Cu中加入硫酸和硝酸的混酸溶液制取CuSO4溶液,则混酸中硫酸与硝酸的最佳物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com