
| A. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-11.46 kJ•mol-1 | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-11.46 kJ•mol-1 | |
| C. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=+114.6 kJ•mol-1 | |
| D. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
分析 11.2g KOH的物质的量为:$\frac{11.2g}{56g/mol}$=0.2mol,1L 0.1mol•L-1的H2SO4溶液中氢离子的物质的量为:0.1mol/L×2×1L=0.2mol,则氢氧化钾恰好与硫酸反应生成硫酸钾和0.2mol水,据此可计算出生成1mol水放出的热量,然后结合中和热的概念写出反应的热化学方程式.
解答 解:11.2g KOH的物质的量为:$\frac{11.2g}{56g/mol}$=0.2mol,1L 0.1mol•L-1的H2SO4溶液中氢离子的物质的量为:0.1mol/L×2×1L=0.2mol,则氢氧化钾恰好与硫酸反应生成硫酸钾和0.2mol水,当生成1mol水时放出的热量为:11.46kJ×$\frac{1mol}{0.2mol}$=57.3kJ,
A.生成1mol水时放出的热量为57.3kJ,故A错误;
B.2mol氢氧化钾反应生成2mol水放出的热量应该为:57.3kJ×2=114.6kJ,故B错误;
C.中和反应是放热反应,焓变应该为负值,故C错误;
D.KOH的稀溶液与H2SO4溶液反应生成0.2mol水放出11.46kJ的热量,生成1mol水会放出57.3KJ的能量,该反应的热化学方程式为:KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1,故D正确;
故选D.
点评 本题考查了热化学方程式的书写,题目难度不大,明确热化学方程式中的书写原则为解答关键,注意掌握中和热的概念及应用,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
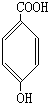
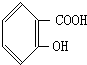 、
、 、
、
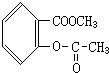 、
、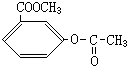 、
、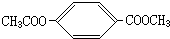 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知二氧化硫可使高锰酸钾溶液褪色反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
已知二氧化硫可使高锰酸钾溶液褪色反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
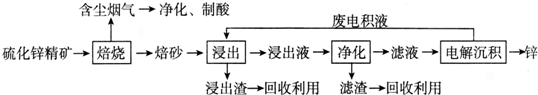
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤 | 实验方案 | 预期现象和结论 |
| ① | 用药匙取少许样品粉末,加入试管A中,再用胶头滴管取过量的NaOH溶液加入试管A中,充分反应后,静置.弃去上层清液,剩余固体备用. | 粉末部分溶解,并有气体放出,则合金中一定含有铝 |
| ② | 向试管A的剩余固体中加入过量的稀硫酸充分反应后,静置,取上层清液于试管B中,剩余固体备用. | 固体部分溶解,并有气体放出,溶液呈浅绿色,则合金中可能含有 铁. |
| ③ | 在试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变成黄色,加KSCN后显血红色,结合②可知,一定含铁 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,则合金中一定含有铜. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq) | B. | HCl(aq) | C. | Fe2(SO4)3(aq) | D. | CuSO4(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
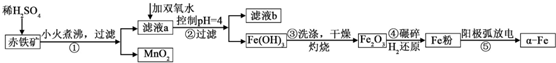
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
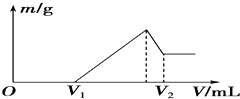 0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答:
0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com