
��һ�������£���һ���������ܱ������г���1mol N2��3mol H2���������з�Ӧ�� N2��g����3H2 2NH3��g���ﵽƽ���ı�����������NH3����ƽ��Ũ�Ȳ��ı����
2NH3��g���ﵽƽ���ı�����������NH3����ƽ��Ũ�Ȳ��ı����
A�������¶Ⱥ�����������䣬����1mol NH3 ��g��
B�������¶Ⱥ�������ѹǿ���䣬����1mol N2 ��g��
C�������¶Ⱥ�������ѹǿ���䣬����1mol NH3 ��g��
D�������¶Ⱥ�������ѹǿ���䣬����1mol Ar ��g��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й��������ʵ�Ӧ����ȷ����(����)
A���Ȼ�����Һ�����ԣ������������������Ȼ�����Һ
B��̼������Һ�Լ��ԣ������ȵĴ�����Һ��ȥ����������������
C��������ѧ����ͨ�������ã��ɽ����ȵ�þ�۷��ڵ�������ȴ
D��п�Ľ����Ա���ǿ���ɽ����ֽ�ˮ��������п���Լ������帯ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ܱ������У�ͨ��x molH2��y mol I2��������������ӦH2 (g)��I2 (g) =2 HI(g) �ı�������������Ӧ������θı䣨������С�䣩
�š������¶ȡ�������������������
�ơ���������H2_____________
�ǡ����������������������������������
�ȡ�����ѹǿ����ʱ��ͨ����������������
�ɡ������ݻ�����ʱ��ͨ�뵪��������������������
�ʡ�����������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ɻ��������������泥�NH4ClO4���Ļ����Ϊ����ȼ�ϣ���ȼʱ����������������������立�Ӧ���䷽��ʽ�ɱ�ʾΪ��2NH4ClO4��N2����4H2O��Cl2����2O2�� ��H��0�����жԴ˷�Ӧ�������д������
A��������Ӧ���ڷֽⷴӦ
B��������Ӧ˲������������������ƶ�����ɻ�����
C����Ӧ�������仯��˵����Ҫ�ǻ�ѧ��ת��Ϊ���ܺͶ���
D���ڷ�Ӧ�и������ֻ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ���Ʊ����跴Ӧ���Ȼ�ѧ����ʽ���£�
SiCl4(g)+2H2(g) 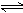 Si(s)+4HCl(g)
Si(s)+4HCl(g)  mol(Q��0)
mol(Q��0)
ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ(��������Ϊ���淴Ӧ)������������ȷ����
A.��Ӧ�����У�������ѹǿ�����SiCl4��ת����
B.����Ӧ��ʼʱSiCl4Ϊ1 mol,���ƽ��ʱ����������ΪQ kJ
C.��Ӧ��4 minʱ����HClŨ��Ϊ0.12 mol/L,��H2�ķ�Ӧ����Ϊ0.03 mol/(L��min)
D.����Ӧ��������Ϊ0.025Q kJʱ�����ɵ�HClͨ��100 mL 1 mol/L��NaOH��Һǡ�÷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NH3(g)ȼ������NO2 (g)��H2O(g)����֪
��1��2H2(g)+ O2 (g)=2H2O(g) ��H =��483.6 kJ/mol
��2��N2 (g)+2O2 (g)=2NO2 (g) ��H = + 67.8 kJ/mol
��3��N2 (g)+ 3H2 (g)=2NH3(g) ��H =��92.0 kJ/mol
�Լ����д��NH3(g)ȼ�յ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й����зų���������
A����Ͷ�������� B��Һ̬ˮ���ˮ����
C������ʯ��ʯ������ʯ�ҺͶ�����̼ D�������ӱ����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����pH=3�Ĵ����pH=3������������Һ������˵����ȷ����
A����ˮϡ��100��������Һ��pH����ͬ
B������Һ�зֱ����������пƬ�ų�H2�������ͬ
C�������е�c (CH3COO��)�������е�c(SO42��) ��ͬ
D������Һ��ˮ�������c(H+)=1��10��11mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���0.05mol Na2CO3��������ˮ���100mL��Һ������Һ�м����������ʡ��йؽ�����ȷ����
| ��������� | ���� | |
| A | 50mL 1mol·L��1H2SO4 | ��Ӧ������c(Na+)=c(SO42��) |
| B | 0.05molCaO | ��Һ�� |
| C | 50mL H2O | ��ˮ�������c(H+)·c(OH—)���� |
| D | 0.1molNaHSO4���� | ��Ӧ��ȫ����ҺpH��С��c(Na+)���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com