
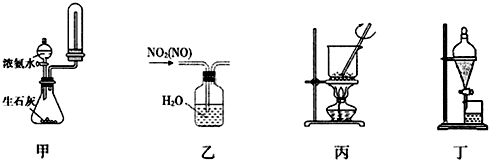
| A. | 用装置甲制取并收集干燥纯净的NH3 | |
| B. | 用装置乙除去NO2中混有的少量NO | |
| C. | 用装置丙将氢氧化钠固体加热熔融 | |
| D. | 用装置丁把溴水中的溴萃取分离出来 |
分析 A.收集氨气的试管不能堵塞;
B.二氧化氮与水反应;
C.氢氧化钠固体加热熔融应在铁坩埚中进行;
D.溴不易溶于水,易溶于有机溶剂.
解答 解:A.收集氨气的试管不能堵塞,应在试管口塞一团棉花,故A错误;
B.二氧化氮与水反应,将原物质除去,不能除杂,故B错误;
C.NaOH与玻璃中的二氧化硅反应,则氢氧化钠固体加热熔融应在铁坩埚中进行,故C错误;
D.溴不易溶于水,易溶于有机溶剂,则萃取分离,图中萃取、分液装置合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、混合物分离提纯等,把握物质的性质、混合物分离提纯原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钠是淡黄色固体 | |
| B. | 钠的密度:小于煤油大于水 | |
| C. | 钠在化学反应中只能做还原剂 | |
| D. | 钠与硫酸铜溶液反应有红色的铜生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 细铁丝在氧气里点燃后剧烈燃烧,火星四射,产生黑色固体 | |
| B. | 氢气燃烧产生淡蓝色火焰 | |
| C. | 硫在空气中燃烧产生明亮的蓝紫色火焰,并生成有刺激性气味的气体 | |
| D. | 红磷在空气中燃烧产生大量白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 化学小组的同学利用如图所示装置进行实验.集气瓶中装有纯净物A,分液漏斗中盛有物质B.
化学小组的同学利用如图所示装置进行实验.集气瓶中装有纯净物A,分液漏斗中盛有物质B.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A极为负极,Cu为阳极 | |
| B. | 左烧杯溶液和右烧杯溶液的pH都变小 | |
| C. | 左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1 | |
| D. | 左烧杯溶液浓度变大,右烧杯溶液浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 氢氧燃料电池的能量转换形式之一为化学能转化为电能 | |
| D. | 催化剂通过降低化学反应的焓变加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
 ,则氨气的平衡转化率是75%.
,则氨气的平衡转化率是75%.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z分别为H、C、N、O元素
W、X、Y、Z分别为H、C、N、O元素查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com