
| A、2:1 | B、1:2 |
| C、1:3 | D、1:4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最终得到的溶液中:C(Na+)=C(Cl-)+C(OH-) |
| B、反应过程中得到标准状况下气体的体积为7.84L |
| C、最终得到C(Na+)=1.5mol/L |
| D、最终得到沉淀为Al(OH)3,质量是7.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
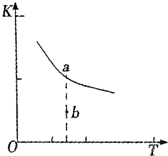 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 C2H4 |
| B、CH4 C3H6 |
| C、C2H4 C3H4 |
| D、CH4 C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将25g CuSO4?5H2O溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液 |
| B、检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体 |
| C、用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| D、用银氨溶液鉴别葡萄糖和蔗糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com