
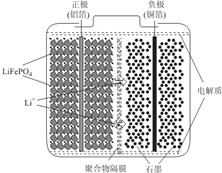
 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.分析 (1)①根据原子守恒分析;
②C2O42-中C的化合价为+3价,生成CO和CO2,C元素的化合价分别为+2价、+4价,根据电子与LiFePO4的关系计算;
③亚铁离子容易被氧气氧化;
(2)放电时,Li1-xFePO4在正极上得电子发生氧化反应;充电时,阳离子向阴极移动;电解质为锂盐,锂离子通过交换膜向正极移动;
(3)电解精炼铜得到铜0.32g时,电解消耗的电量Q=znF,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量,根据电流利用效率=$\frac{负载利用电量}{电池输出电量}$,可计算出电流利用率;
(4)LiFePO4中亚铁离子在酸性条件下,被双氧水氧化为铁离子.
解答 解:(1)①由原子守恒可知,Li2CO3+2FeC2O4•2H2O+2NH4H2PO4═2LiFePO4+2NH3↑+3CO2↑+2CO↑+7H2O↑,
故答案为:2LiFePO4;2CO↑;7H2O↑;
②C2O42-中C的化合价为+3价,生成CO和CO2,C元素的化合价分别为+2价、+4价,生成2molCO转移2mol电子,同时生成2molLiFePO4,则当反应中每转移0.15mol电子,生成0.15molLiFePO4,其质量为23.7g,
故答案为:23.7;
③亚铁离子容易被氧气氧化,所以要隔绝氧气,即反应需在惰性气氛的保护中进行,
故答案为:防止Fe(Ⅱ)被氧化;
(2)电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜,
故答案为:Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
(3)LiFePO4+6C$?_{放电}^{充电}$Li1-xFePO4+LixC6,电解精炼铜得到铜0.32g时,即铜的物质的量为$\frac{0.32}{64}$=0.005mol,所以电解消耗的电量Q=2×0.005mol×96500C/mol=965C,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量Q=It=2.0×10×60=1200C,根据电流利用效率=$\frac{负载利用电量}{电池输出电量}$=$\frac{965}{1200}$×100%=80.4%,
故答案为:80.4%;
(4)LiFePO4中亚铁离子在酸性条件下,被双氧水氧化为铁离子,则发生反应的离子方程式为2LiFePO4+2H++H2O2═2Li++2Fe3++2PO43-+2H2O,
故答案为:2LiFePO4+2H++H2O2═2Li++2Fe3++2PO43-+2H2O.
点评 本题综合考查了物质的制备原理、原电池和电解池工作原理及相关计算,侧重于学生的分析能力和计算能力的考查,熟悉原电池、电解池工作原理及各个电极发生反应,难点是电流利用率的计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 为了确定是否存在Cl-,可向溶液中加入硝酸酸化的硝酸银溶液 | |
| C. | c(HCO3-)=0.05mol/L | |
| D. | 4.88g沉淀中含有3种成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有气体生成 | |
| B. | Na+浓度基本不变 | |
| C. | HCO3-浓度减小而CO32-浓度增大 | |
| D. | SO32-发生反应的离子方程式为:SO32-+Na2O2+H2O=2Na++SO42-+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+在反应①中作氧化剂,在反应②中为氧化产物 | |
| B. | 若生成标准状况下22.4 L O2,则整个过程中转移电子总数为2 mol | |
| C. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| D. | 在工业生产H2O2过程中要严格避免混入Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com