
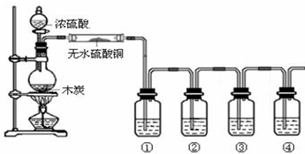
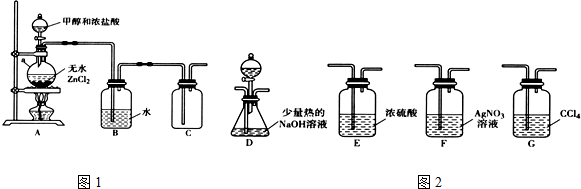
分析 浓硫酸和碳在加热条件下反应生成二氧化碳、二氧化硫和水;验证生成产物成二氧化碳、二氧化硫和水,需要先利用无水硫酸铜检验水蒸气的生成,依次用①检验二氧化硫气体用品红试液褪色证明,②装置利用高锰酸钾溶液除去二氧化硫,③装置利用品红试液检验二氧化硫是否除净,④装置中利用澄清石灰水变浑浊证明二氧化碳的存在,据此回答.
解答 解:(1)装置中盛浓硫酸的仪器名称是分液漏斗,浓硫酸和碳在加热条件下反应生成二氧化碳、二氧化硫和水,大玻璃管内无水硫酸铜遇到水表面的现象是变为蓝色,验证生成产物成二氧化碳、二氧化硫和水,需要先利用无水硫酸铜检验水蒸气的生成,依次用①检验二氧化硫气体用品红试液褪色证明,②装置利用高锰酸钾溶液除去二氧化硫,③装置利用品红试液检验二氧化硫是否除净,④装置中利用澄清石灰水变浑浊证明二氧化碳的存在,故答案为:分液漏斗;变为蓝色;品红溶液;酸性高锰酸钾溶液;品红溶液;澄清石灰水.
(2)检验二氧化硫气体用品红试液褪色证明,故答案为:①中品红溶液褪色;
(3)③中品红溶液不褪色;④中澄清石灰水变浑浊,证明所得产物含CO2,故答案为:③中品红溶液不褪色;④中澄清石灰水变浑浊;
(4)木炭和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4浓$\frac{\underline{\;加热\;}}{\;}$2SO2↑+CO2↑+2H2O.故答案为:C+2H2SO4浓$\frac{\underline{\;加热\;}}{\;}$2SO2↑+CO2↑+2H2O.
点评 本题考查了浓硫酸性质的分析判断,产物的实验设计和实验验证方法、试剂选择、反应现象的判断,题目难度中等.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
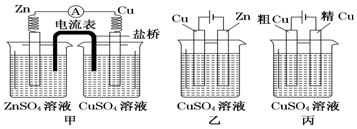
| A. | 甲是原电池,乙是电镀装置 | |
| B. | 甲、乙装置中,锌极上均发生氧化反应 | |
| C. | 乙装置中,铜极因发生氧化反应而溶解 | |
| D. | 乙装置中,c(Cu2+)不变,丙装置中,c(Cu2+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;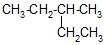 的系统命名为3-甲基戊烷;
的系统命名为3-甲基戊烷; ;
;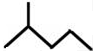 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com