
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________;Y与过量浓硝酸反应后溶液中含有的盐的化学式为______________________________________________________________。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是________。
A.Mg2+ B.Fe2+
C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
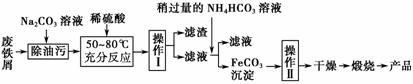
回答下列问题:
①操作Ⅰ的名称是________;操作Ⅱ的名称是________;操作Ⅱ的方法为______________________________________________________________。
②请写出生成FeCO3沉淀的离子方程式:_________________________ _______________________________________________。
解析 (1)铁的氧化物中具有磁性的是Fe3O4,Fe3O4溶于过量的盐酸后溶液中存在的阳离子是Fe2+、Fe3+、H+;Fe3O4溶于过量的浓硝酸后Fe元素会被氧化为Fe3+,所以反应后的溶液中含有的盐是Fe(NO3)3。(2)向该溶液中加入过量的NaOH溶液后:Mg2+→Mg(OH)2、Fe2+→Fe(OH)3、Al3+→AlO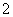 、Cu2+→Cu(OH)2;过滤后滤渣中含有Mg(OH)2、Fe(OH)3、Cu(OH)2;高温灼烧后Mg(OH)2→MgO、Fe(OH)3→Fe2O3、Cu(OH)2→CuO;将MgO、Fe2O3、CuO投入过量盐酸后生成Mg2+、Fe3+、Cu2+,故应选择B、C。(3)①从流程图中知道经操作Ⅰ得到滤渣和滤液,故该操作是过滤;操作Ⅱ是在得到FeCO3沉淀后进行的,故该操作是洗涤;洗涤具体操作方法为:在普通漏斗中加入适量蒸馏水,浸没沉淀,让蒸馏水自然流下,重复操作2~3次;②从流程图中分析加入稍过量的NH4HCO3溶液,有FeCO3沉淀,还应有CO2生成,发生复分解反应的离子方程式为:Fe2++2HCO
、Cu2+→Cu(OH)2;过滤后滤渣中含有Mg(OH)2、Fe(OH)3、Cu(OH)2;高温灼烧后Mg(OH)2→MgO、Fe(OH)3→Fe2O3、Cu(OH)2→CuO;将MgO、Fe2O3、CuO投入过量盐酸后生成Mg2+、Fe3+、Cu2+,故应选择B、C。(3)①从流程图中知道经操作Ⅰ得到滤渣和滤液,故该操作是过滤;操作Ⅱ是在得到FeCO3沉淀后进行的,故该操作是洗涤;洗涤具体操作方法为:在普通漏斗中加入适量蒸馏水,浸没沉淀,让蒸馏水自然流下,重复操作2~3次;②从流程图中分析加入稍过量的NH4HCO3溶液,有FeCO3沉淀,还应有CO2生成,发生复分解反应的离子方程式为:Fe2++2HCO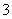 ===FeCO3↓+CO2↑+H2O。
===FeCO3↓+CO2↑+H2O。
答案 (1)Fe2+、Fe3+、H+ Fe(NO3)3
(2)BC
(3)①过滤 洗涤 在普通漏斗中加入适量蒸馏水,浸没沉淀,让蒸馏水自然流下,重复操作2~3次 ②Fe2++2HCO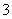 ===FeCO3↓+CO2↑+H2O
===FeCO3↓+CO2↑+H2O


科目:高中化学 来源: 题型:
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法中正确的是 ( )。
A.从海水中提取溴时,不涉及氧化还原反应
B.苯与溴水反应生成溴苯
C.可以用CCl4萃取溴水中的溴
D.向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
将11.9 g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下的体积为3.36 L。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀19.4 g,则上述反应中生成NO气体的体积为(标准状况下) ( )。
A.6.72 L B.11.2 L
C.22.4 L D.4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如下图所示:
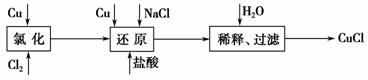
试回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是______________________________________________________________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式___________ ____________________________________________________________。
制备过程中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?
(已知Cu2++Cu+2Cl-===2CuCl)
___________________________________________________________。
(3)还原过程中加入少量盐酸的作用是________________________,加入过量NaCl的原因是___________________________________________________ ___________________________________________________。
(4)合成结束后所得产品用酒精淋洗的目的是___________________________ ___________________________________________________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式________________________________________ ______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )。
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜(2014·全国新课标Ⅰ,8D)
②室温下,不能将浓硫酸盛放在铁桶中(2014·全国大纲,6B)
③K+、Fe3+、NO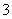 、SCN-在水溶液中能大量共存(2014·广东理综,8D)
、SCN-在水溶液中能大量共存(2014·广东理综,8D)
④因氧化铁能与酸反应,可用于制作红色涂料(2014·江苏化学,4D)
⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质(2014·四川理综,4B)
A.仅①②③ B.仅①③④
C.仅②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的镁和铝均匀混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 ( )。
A.3 mol·L-1盐酸 B.4 mol·L-1 HNO3溶液
C.5 mol·L-1 NaOH溶液 D.18.4 mol·L-1 H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1 mol·L-1 Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是 ( )。

A.图中C点铝元素存在形式是AlO
B.向D点溶液中通入CO2气体,立即产生白色沉淀
C.原混合溶液中c[Al2(SO4)3]∶c(AlCl3)=1∶2
D.OA段反应的离子方程式为2Al3++3SO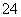 +3Ba2++8OH-===2AlO
+3Ba2++8OH-===2AlO +3BaSO4↓+4H2O
+3BaSO4↓+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应SiO2+3C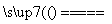 SiC+2CO↑的叙述中,正确的是 ( )。
SiC+2CO↑的叙述中,正确的是 ( )。
A.氧化剂是SiO2
B.氧化剂与还原剂的物质的量之比为1∶2
C.碳在反应中只作还原剂
D.若生成1 mol SiC,则转移电子2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属钠及其化合物的描述正确的是
A.将少量金属钠投入饱和NaHCO3溶液中,会有晶体析出
B.Na2O和Na2O2所含的阴阳离子个数比均相同
C.利用澄清石灰水可鉴别Na2CO3溶液与NaHCO3溶液
D.将1 mol金属钠投入到足量CuSO4溶液中,反应后溶液质量增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com