
分析 依据“A的相对分子质量为H2的15倍”得出A的相对分子质量为30,实验式为CH2O,据此得出A为甲醛;
B、C蒸汽密度与同温同压下丙醇蒸汽密度相同,丙醇的相对分子质量为60,据此解答即可.
解答 解:“A的相对分子质量为H2的15倍”得出A的相对分子质量为30,实验式为CH2O,据此得出A为甲醛;
B、C蒸汽密度与同温同压下丙醇蒸汽密度相同,丙醇的相对分子质量为:60,B能与金属钠反应,则B为醇类,与丙醇互为同分异构体,那么B应为2-丙醇,结构简式为:CH3CH(OH)CH3,C不能与金属钠反应,那么C应为醚类,结构简式为:CH3CH2OCH3,
故答案为:甲醛;2-丙醇;CH3CH(OH)CH3;CH3CH2OCH3.
点评 本题主要考查的是有机物的推断,涉及醇类的性质,有机物官能团的判断等,综合性较强,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
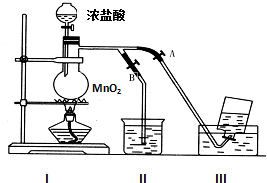 如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、NO3-、SiO32- | B. | Ca2+、Fe3+、Cl-、CO32- | ||
| C. | Na+、SO42-、OH-、NO3- | D. | NH4+、OH-、Cl-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按以下步骤从
按以下步骤从 合成
合成  .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 、D
、D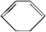 .
.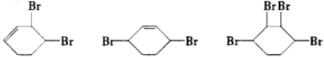 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O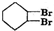 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com