
【题目】根据图中A~I均为中学化学中常见物质.其中A、B、 C、D为单质,通常情况下A为黄绿色气体,B为固体,C、D为无色气体:其余为化合物,其中常温下E是无色气体.其水溶液为强酸,G是具有磁性的物质,常温下I为液体。
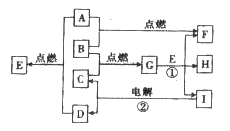
(1)写出下列物质的化学式:A________;F______;G_________。
(2)反应①的离子方程式为______________________________________。
(3)实验室要除去A气体中少量E,将混和气体通过盛有__________的洗气瓶洗气。
(4)F、 H可相互转化,写出一种F转化为H的化学方程式:__________________。
(5)请设计一组实验方案检验F中阳离子:_________________________________。
【答案】 Cl2 FeCl3 Fe3O4 Fe3O4+8H+==2Fe3++ Fe2++4H2O 饱和食盐水 Fe+2FeCl3==3FeCl2 取少量的F于试管中,滴加硫氰化钾溶液,若溶液变为红色则,F中的阳离子为Fe3+
【解析】通常情况下A为黄绿色气体,A是氯气。B为固体,G是具有磁性的物质,G是四氧化三铁,B是铁,C是氧气。常温下I为液体,I是水,电解水生成氢气和氧气,D是氢气。氢气在氯气中燃烧生成氯化氢,E是氯化氢。四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水。铁在氯气中燃烧生成氯化铁,F是氯化铁,所以H是氯化亚铁。则
(1)根据以上分析可知A是 Cl2,F是FeCl3,G是Fe3O4。(2)反应①的离子方程式为Fe3O4+8H+=2Fe3++ Fe2++4H2O。(3)氯化氢极易溶于水,实验室要除去氯气气体中少量氯化氢,将混和气体通过盛有饱和食盐水的洗气瓶洗气。(4)氯化铁与铁反应生成氯化亚铁,反应的化学方程式为Fe+2FeCl3=3FeCl2。(5)检验铁离子的实验方案为:取少量的F于试管中,滴加硫氰化钾溶液,若溶液变为红色则说明F中的阳离子为Fe3+。


科目:高中化学 来源: 题型:
【题目】合金相对纯金属制成的金属材料来说优点是( )
①合金的硬度一般比它的各成分金属的大
②一般合金的熔点比它各成分金属的更低
③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
A. ①②③⑤ B. ②③④ C. ①②④ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)化学是一门以实验为基础的学科,化学所取得的丰硕成果与实验的重要作用分不开。结合下列实验装置图回答问题:

(1)写出上图中所示仪器的名称:①___;②___。
(2)若利用该装置分离乙酸(沸点118 ℃)和乙酸乙酯(沸点77.1 ℃)的混合物,还缺少的仪器有___,将仪器补充完整后进行的实验操作的名称为___;实验时仪器②中冷却水的进口为________(填“f”或“g”)。
(3)应用上述分离操作,首先得到的物质是________。
(4)蒸馏烧瓶内碎瓷片的作用是________________。
(Ⅱ)硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是________mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀硫酸,则配制稀硫酸时需要取________mL的该硫酸;配制时需选用的仪器主要有量筒、烧杯、玻璃棒、___、___(在横线上填写所缺仪器的名称)。
(3)配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是___(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是人类生活中不可缺少的物质,海水中含有大量食盐。某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl。

请回答:
(1)加入的A是__________,检验A已过量的方法是___________。
(2)加入的B是__________,加入稍过量B的目的是__________。
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入_________________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程。 请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.
①称取2.520g纯草酸晶体,将其制成100.00mL水溶液为待测液。
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4.
③用浓度为0.1000molL-1 的KMnO4标准溶液进行滴定,达到终点时消耗20.00mL。
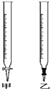
(1)滴定时,将酸性KMnO4标准液装在如图中的______(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是________________;
(3)通过上述数据,求得x=______;
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会______(填“偏大”、“偏小”或“不变”,下同);
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x会__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲在实验室中完成Fe与水蒸气反应的实验,实验装置如图甲、乙所示。

已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G 为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性?________________。
(2)乙装置中湿沙子的作用是________________。
(3)B处发生反应的化学方程式为_________________。
(4)该同学认为欲在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是________________。
(5)对比甲、乙两装置的B和K,B的优点是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com