
| A. | 镁在空气中和纯净氧气中的燃烧产物只有MgO | |
| B. | 硫在空气中的燃烧产物是SO2,在纯净氧气中的燃烧产物是SO3 | |
| C. | 钠在敞口容器中长期放置和在空气中燃烧的产物都是Na2O2 | |
| D. | 浓H2SO4和浓盐酸敞口放置在空气中,其溶质的质量分数都将减小 |
分析 A.镁在空气中燃烧生成氧化镁、氮化镁;镁在纯氧中燃烧生成MgO;
B.硫在空气或纯氧中燃烧都生成二氧化硫;
C.钠和氧气接触反应生成氧化钠,钠燃烧生成过氧化钠;
D.浓硫酸具有吸水性,浓盐酸具有挥发性.
解答 解:A.镁在空气中和氧气、二氧化碳反应生成MgO,和氮气反应生成氮化镁;Mg在纯氧中燃烧生成MgO,所以产物不同,故A错误;
B.硫在空气或纯氧中燃烧都生成二氧化硫,与氧气纯度无关,二氧化硫和氧气在催化剂、加热条件下反应生成三氧化硫,故B错误;
C.钠和氧气接触反应生成氧化钠,钠燃烧生成过氧化钠,所以钠和氧气的反应产物与反应条件有关,故C错误;
D.浓硫酸具有吸水性,浓盐酸具有挥发性,所以浓H2SO4和浓盐酸敞口放置在空气中,浓硫酸中溶液体积增大、浓盐酸中氯化物物质的量减小,则其溶质的质量分数都将减小,故D正确;
故选D.
点评 本题考查元素化合物性质,为高频考点,涉及浓硫酸吸水性、浓盐酸的挥发性、镁及钠的性质,注意镁能和二氧化碳反应,有些化学反应产物与反应条件、反应物的量、反应物浓度等因素有关,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①②③④⑤⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
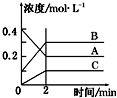
| A. | A是反应物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 达平衡后,若升高温度,平衡向正反应方向移动 | |
| D. | 反应的方程式为:2A(g)?2B(g)+C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.其中A原子所处的周期数、族序数都与其原子序数相等.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18 列中的第7列元素.D的原子序数比E小5,D跟B可形成离化合物其晶胞结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
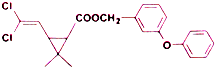
| A. | 分子式为C21H20O3Cl2 | |
| B. | 醚键上的氧原子至少与另外11个原子共面 | |
| C. | 分子中不存在手性碳原子 | |
| D. | 在一定条件下可发生加成、取代、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  给液体加热 | B. | 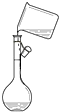 转移溶液 | C. | 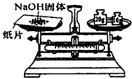 称取NaOH固体 | D. | 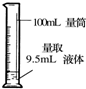 量取液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol•L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com