
分析 (1)摩尔质量以g/mol为单位,数值等于其相对分子质量;
(2)根据n=$\frac{m}{M}$计算;
(3)H218O分子所含的质子数为2+8=10,质子的物质的量为水分子的10倍,1个水分子含有3个原子,根据N=nNA计算.
解答 解:(1)18O2相对分子质量为36,摩尔质量以g/mol为单位,数值等于其相对分子质量,所以18O2气体的摩尔质量为36g/mol,
故答案为:36g/mol;
(2)1.8g 18O形成的气体为18O2,气体的物质的量n=$\frac{1.8g}{36g/mol}$=0.05mol,
故答案为:0.05mol;
(3)H218O分子所含的质子数为2+8=10,质子的物质的量为水分子的10倍,0.1mol重氧水H${\;}_{2}^{18}$O中所含质子的物质的量为1mol,1个水分子含有3个原子,0.1mol重氧水所含原子的数目为:N=nNA=0.1mol×3NA=0.3NA,
故答案为:1mol;0.3NA.
点评 本题考查物质的量有关计算,注意原子结构、核素等,注意对基础知识的理解,题目难度不大.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
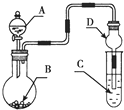
| A. | 若A为浓盐酸,B为KMnO4晶体,C是紫色石蕊溶液,则C中溶液最终呈红色 | |
| B. | 若A为浓硫酸,B为Na2SO3固体,C中是NaOH溶液,实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解 | |
| D. | 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
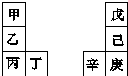 甲~辛等元素在周期表中的相对位置如表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>戊>己 | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、O最高正价依次升高 | B. | 钠、镁、铝的还原性依次减弱 | ||
| C. | HC1、HBr、HI的稳定性依次增强 | D. | H3PO4、H2SO4、HC1O的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷与氢氧化钠水溶液共热 | |
| B. | 溴乙烷与氢氧化钠的乙醇溶液共热 | |
| C. | 乙烯与氯气 | |
| D. | 乙炔与氯化氢在一定条件下制氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
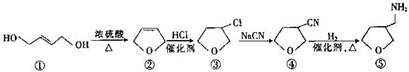
| A. | 有机物①与乙烯互为同系物 | |
| B. | 有机物③转化为有机物④的反应属于加成反应 | |
| C. | 有机物④转化为有机物⑤的反应中反应物的物质的量之比为1:1 | |
| D. | 含有一个四元环,且能与金属钠反应的有机物③的同分异构体(不考虑立体异构)有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 | |
| D. | 甲烷中心原子的价电子全部成键且成键的对象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
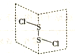 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示.
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com