
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。该工艺的主要流程如图所示:
已知部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为____。
(2)滤液中含钒的主要成分________(写化学式)。反应①的离子方程式___________________。
(3)萃取和反萃取过程中所需的主要玻璃仪器为_____________。若反萃取使用硫酸用量过大,进一步处理会增加_______(填化学式)的用量,造成成本增大。
(4)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式___________________。“沉淀”过程中,沉钒率受温度、氯化铵系数(NH4Cl的质量与调节pH之后的料液中VO3-的质量比)等的影响,其中温度与沉钒率的关系如图所示,温度高于80℃沉钒率降低的可能原因是___________________________。

(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,③中加入氨水,调节溶液的最佳pH值为____。若矾沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____。(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(6)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5)。取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1molL-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是______________。
【答案】 3V2O5 + 10Al![]() 6V + 5Al2O3 VOSO4 V2O5 + SO32- + 4H+ = 2V02+ +SO42- +2H2O 分液漏斗 NH3·H2O NH4+ + VO3- = NH4VO3 ↓ 温度高于80℃,导致部分氯化铵分解 1.7~1.8 2.6×10-3mol/L 95.55%
6V + 5Al2O3 VOSO4 V2O5 + SO32- + 4H+ = 2V02+ +SO42- +2H2O 分液漏斗 NH3·H2O NH4+ + VO3- = NH4VO3 ↓ 温度高于80℃,导致部分氯化铵分解 1.7~1.8 2.6×10-3mol/L 95.55%
【解析】(1)铝与五氧化二钒反应生成钒与氧化铝,反应方程式为![]()
(2)因为VOSO4可溶,V2O5难溶,所以滤液中含钒的主要成分VOSO4。V2O5具有氧化性,Na2SO3具有还原性,所以反应①的离子方程式V2O5 + SO32- + 4H+ = 2V02+ +SO42- +2H2O。
(3)萃取和反萃取过程中所需的主要玻璃仪器为分液漏斗。若反萃取使用硫酸用量过大,进一步处理会增加NH3·H2O的用量,造成成本增大
(4)因为反应③为 NH4VO3为难溶性物质,所以该步发生反应的离子方程式NH4++ VO3-=NH4VO3。由图分析80℃之前沉钒率逐渐升高。80℃之后因为氯化铵受热分解了,导致NH4+离子浓度降低了,所以沉钒率逐渐减小。答案:NH4+ + VO3-=NH4VO3,温度高于80℃,导致部分氯化铵分解。
NH4VO3为难溶性物质,所以该步发生反应的离子方程式NH4++ VO3-=NH4VO3。由图分析80℃之前沉钒率逐渐升高。80℃之后因为氯化铵受热分解了,导致NH4+离子浓度降低了,所以沉钒率逐渐减小。答案:NH4+ + VO3-=NH4VO3,温度高于80℃,导致部分氯化铵分解。
根据表中数据判断,(5)中加入氨水,调节溶液pH最佳值为1.7-1.8(或1.7、1.8其中一个),此时钡沉淀率达到最大,需要调节的PH较小;若钒沉淀率为93.1%,时不产生Fe(OH)3沉淀,此时PH=2,氢离子浓度=10-2 mol/L ,c(OH-)=10-12 mol/L,则溶液中才c(Fe3+)浓度根据溶度积计算Ksp[Fe(OH)3]=c(Fe3+). c3 (OH-)=2.6×10-39,,计算得到c(Fe3+)=2.6×10-3 mol/L,不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<4.0×10-2 mol/L.,因此,本题正确答案是: 1.7-1.8 (或1.7、1.8其中一个);2.6×10-3mol/L.。
(6)根据题意V2O5+SO32-+4H+ =2V02++SO42-+2H2O,V02+被ClO3-氧化,由ClO3-+6 V02++6H+=6VO3++Cl-+3H2O ,可知
3V2O5~-6V02+~ClO3-
3mol 1mol
n 0.0105mol
解得n=0.0315mol,因此该实验中钒的回收率=[(0.0315mol×182g/mol )/(100g×6%.)]×100%=95.55%。


科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述正确的是
A. 周期表中有8个A族,8个B族
B. 目前使用的元素周期表中,最长的周期含有32种元素
C. 短周期元素是指1-20号元素
D. 原子及其离子的核外电子层数都等于该元素所在的周期数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的元素,如:钛(22Ti)、铁(26Fe)、砷、硒、锌等及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为___________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有______种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是______________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
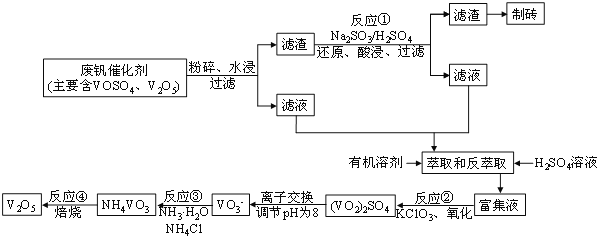
(4)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如图,As原子的杂化方式为____________,雌黄和SnCl2在盐酸中反应转化为雌黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式__________________________。SnCl4分子的空间构型为______________。
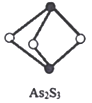
(5)高子化合物CaC2的一种晶体结构如图所示。该物质的电子式___________。一个晶胞含有的π键平均有___________个。
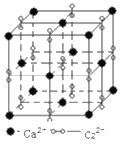
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法正确的是
A.氧化还原反应的实质是电子的转移
B.置换反应不一定是氧化还原反应
C.还原剂被氧化,发生还原反应
D.化合反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)铝合金在航空领域应用广泛,回答下列问题:
(1)基态Ti原子的核外电子排布式为[Ar]_____,其中s轨道上总共有______个电子。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是____,配位体____。
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: n CH3CH=CH2![]()
![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有_______________;反应中涉及的元素中电负性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________。
,该反应中涉及的物质中碳原子的杂化轨道类型有_______________;反应中涉及的元素中电负性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________。
(4)钛与卤素形成的化合物的熔沸点如下表所示,

分析TiCl4、TiBr4 、TiI4的熔点和沸点呈现一定规律的原因是___________________________。
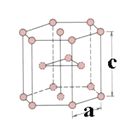
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为 __________________ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.能生成碱的金属元素都在ⅠA族
B.原子序数为14的元素位于元素周期表的第3周期ⅣA族
C.稀有气体元素原子的最外层电子数均为8
D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年冬季,我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。城市雾霾中还含有铜等重金属元素。
(1)N元素原子核外电子云的形状有____________种;基态铜原子的价电子排布式为_______________,金属铜的晶体中,铜原子的堆积方式为________________。
(2)N和O中第一电离能较大的元素是___________;SO42-的空间构型是_______________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为______________,H2O2难溶于CCl4,其原因为__________________。
(4)PM2.5富含大量的有毒、有害物质,如NO、CH3COOONO2(PAN)等。1molPAN中含σ键数目为__________;NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________________。
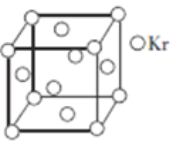
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相邻的Kr原子有m个,晶胞中所含Kr原子有n个,则m/n=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com