
【题目】下列实验操作能达到实验目的的是
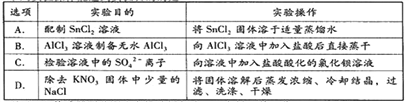
A. A B. B C. C D. D
【答案】D
【解析】A、SnCl2溶于水后要发生水解,生成Sn(OH)2 难溶物而变浑浊 SnCl2+2H2O![]() Sn(OH)2 +2HCl,加浓盐酸时,盐酸中的HCl可以抑制此反应向右进行,防止变浑浊,还要加入一定量的锡粒,加金属锡是为了将氧化变质了的Sn4+还原为Sn2+ ,使溶液保持澄清,故A错误;B、Al3++3H2O
Sn(OH)2 +2HCl,加浓盐酸时,盐酸中的HCl可以抑制此反应向右进行,防止变浑浊,还要加入一定量的锡粒,加金属锡是为了将氧化变质了的Sn4+还原为Sn2+ ,使溶液保持澄清,故A错误;B、Al3++3H2O![]() Al(OH)3+3H+ ,2Al(OH)3
Al(OH)3+3H+ ,2Al(OH)3 ![]() 2Al2O3+3H2O,直接蒸干得不到无水AlCl3,故B错误;C、加盐酸酸化的氯化钡,可能有银离子干扰,故C错误;D、先制成NaCl-KNO3的热饱和溶液,然后冷却结晶,由于KNO3溶解度随温度变化要比 NaCl溶解度随温度变化 大,所以冷却后KNO3溶解度变小,先析出,多结晶几次,就能将得到纯净的KNO3晶体,故D正确。故选D。.
2Al2O3+3H2O,直接蒸干得不到无水AlCl3,故B错误;C、加盐酸酸化的氯化钡,可能有银离子干扰,故C错误;D、先制成NaCl-KNO3的热饱和溶液,然后冷却结晶,由于KNO3溶解度随温度变化要比 NaCl溶解度随温度变化 大,所以冷却后KNO3溶解度变小,先析出,多结晶几次,就能将得到纯净的KNO3晶体,故D正确。故选D。.


科目:高中化学 来源: 题型:
【题目】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
A、容器内气体密度保持不变
B、容器内温度不再变化
C、断裂1mol N≡N键的同时,生成6mol N﹣H键
D、反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g) = ZnO(s) △H =-348.3 kJ/mol
②2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H=________ kJ/mol。
(3)已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g)△H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________。
(4)在水溶液中,YO3n-和S2-发生反应的离子方程式如下:YO3n- + 3S2- + 6H+ = Y-+ 3S↓+ 3H2O
①YO3n-中Y的化合价是_____________;
②Y元素原子的最外层电子数是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
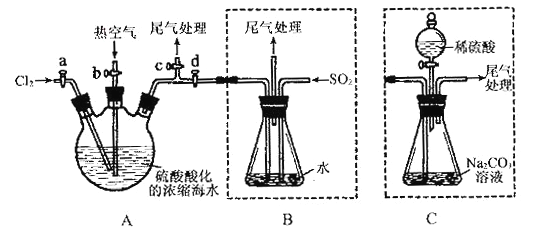
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;②关闭a、c,打开b、d,向A中鼓入足量热空气;③进行步骤②的同时,向B中通入足量SO2 ;④关闭b,打开a,再通过A向B中缓慢通入足量Cl2 ;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:(1)实验室中采用固液加热制备氯气的化学方程式为______________________;
(2)步骤②中鼓入热空气的作用为_________________________;
(3)步骤③B中发生的主要反应的离子方程式为_____________________。
(4)此实验中尾气可用______________(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
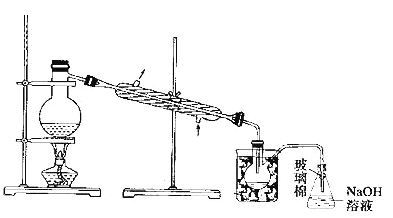
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,请写出滴加稀硫酸时发生反应的离子方程式_________________。
(7)与B装置相比,采用C装置的优点为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述中不正确的是( )

A.双酚A的分子式是C15H16O2
B.双酚A的核磁共振氢谱显示氢原子数之比是1∶2∶2∶3
C.反应①中,1 mol双酚A最多消耗2 mol Br2
D.反应②的产物中只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
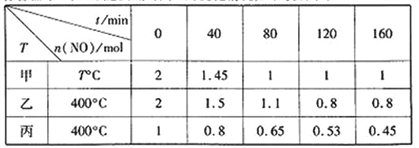
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa
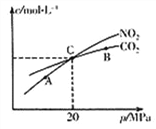 (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为_______________________。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。
实验测得NH4HSO3溶液中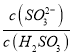 =15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时,
=15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时, 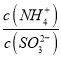 =________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2=CH—CH2OH)可发生的化学反应有( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A. ①②③B. ①②③④
C. ①②③④⑤D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲线如下图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是
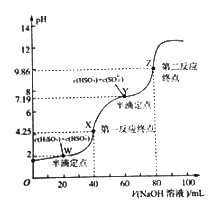
A. H2SO3的Ka1=1×10-2
B. 0.05mol/L NaHSO3溶液的PH=4.25
C. 图中Y点对应的溶液中,3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. 图中Z点对应的溶液中:c(Na+)> c(SO32-)> c(HSO32-)> c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com