
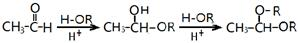

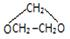 .
. ,F
,F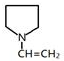 ;
;分析 (I)乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br在氢氧化钠水溶液、加入条件下发生水解反应生成HOrCH2CH2OH,甲醛发生催化氧化生成甲醛,结合信息可知,甲醛与乙二醇先发生加成反应,再形成醚键,故X为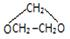 ;
;
(II)反应Ⅲ为F发生加聚反应得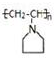 ,所以F为
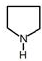
,所以F为 ,依据R2NH+HC≡CH→R2NCH=CH2反应特征,反应Ⅱ为E发生加成反应生成F,所以E为
,依据R2NH+HC≡CH→R2NCH=CH2反应特征,反应Ⅱ为E发生加成反应生成F,所以E为 ,
, 与氨气发生取代反应生成
与氨气发生取代反应生成 .
.
解答 解:(I)乙烯与溴发生加成反应生成BrCH2CH2Br,BrCH2CH2Br在氢氧化钠水溶液、加入条件下发生水解反应生成HOrCH2CH2OH,甲醛发生催化氧化生成甲醛,结合信息可知,甲醛与乙二醇先发生加成反应,再形成醚键,故X为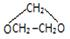 ,
,
(1)反应(2)为卤代烃的水解反应,发生条件为:氢氧化钠水溶液、加热,化合物X的结构简式或键线式结构 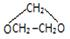 ,
,
故答案为:氢氧化钠水溶液、加热;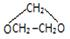 ;
;
(2)反应(3)的化学方程式:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O,
故答案为:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O;
(II)反应Ⅲ为F发生加聚反应得 ,所以F为
,所以F为 ,依据R2NH+HC≡CH→R2NCH=CH2反应特征,反应Ⅱ为E发生加成反应生成F,所以E为
,依据R2NH+HC≡CH→R2NCH=CH2反应特征,反应Ⅱ为E发生加成反应生成F,所以E为 ,
, 与氨气发生取代反应生成
与氨气发生取代反应生成 .
.
(1)比较反应中的反应物和生成物可知,A为加成反应,B为加成反应,C为取代反应,D为加成反应,
故答案为:aABD;
(2)①E的结构简式为 ,F的结构简式为
,F的结构简式为 ,
,
故答案为: ;
; ;
;
②反应I属于取代反应,反应II属于加成反应,
故答案为:取代反应;加成反应.
点评 本题考查有机物的推断与合成,侧重考查学生分析推理能力、信息获取与迁移运用能力,是对有机化学基础的综合考查.


 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
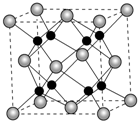 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| B. | 气体单质中一定有σ键,可能有π键 | |
| C. | 乙烯与氢气发生加成反应时,乙烯分子中有π键断裂 | |
| D. | 当原子形成分子时,首先形成σ键,可能形成π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
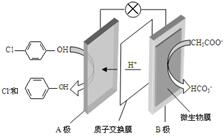 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为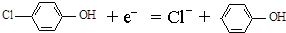 | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| D. | B极为电池的正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
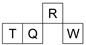 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 原子半径:T>Q>R | |
| C. | 最高价氧化物对应水化物的酸性:Q<W | |
| D. | 含T元素的盐溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 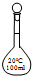 100mL容量瓶 100mL容量瓶 | B. |  100mL集气瓶 | C. | 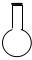 100mL烧瓶 | D. |  100mL滴瓶 100mL滴瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时需加入少量盐酸 | |
| B. | 金属钠保存在装有煤油的带玻璃塞的广口瓶中 | |
| C. | 保存液溴需用水封,放在带橡皮塞子的棕色细口瓶中 | |
| D. | 用稀硝酸洗去附在试管内壁的银镜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com